 Autores:
Autores:
José Augusto Abreu-Reyes, MD, PhD1,2, Rodrigo Abreu-González, MD, PhD1,2
- Centro de Oftalmología Abreu (COA). Tenerife. España
- Servicio de Oftalmología. Complejo Hospitalario Universitario La Candelaria. Tenerife.
España
Institución responsable: Centro de Oftalmología Abreu (COA). Tacoronte. Tenerife. España.
Autor para correspondencia:
José Augusto Abreu Reyes
Centro de Oftalmología Abreu (COA)
Carretera Tacoronte-Tejina, 7
38350 Tacoronte. Tenerife. España
E-mail: jaabreureyes@gmail.com
 SECCIÓN A LA QUE SE DIRIGE EL ARTÍCULO: Artículo Original.
SECCIÓN A LA QUE SE DIRIGE EL ARTÍCULO: Artículo Original.
“Los autores certifican que este trabajo no ha sido publicado ni está en vías de consideración para publicación en otra revista. Asimismo, transfieren los derechos de propiedad (copyright) del presente trabajo a la Sociedad Canaria de Oftalmología”
Conflicto de intereses: Los autores declaran no haber recibido financiación para la realización de este trabajo.
Introducción
Las conjuntivitis por adenovirus (CA) es la causa más común de las conjuntivitis infecciosas, y generalmente no requiere tratamiento. Los signos y síntomas al momento de la presentación son variables1. La forma más común de infección por adenovirus es la fiebre faringoconjuntival (FFC), siendo la más severa la queratoconjuntivitis epidémica (QCE)2, situación en la que se afecta la conjuntiva y la córnea con posible compromiso permanente de la visión. Dichos síndromes vienen definidos por el serotipo de los adenovirus implicados3.
Entre los síntomas que le diferencian del resto de conjuntivitis agudas -bacterianas, alérgicas-, está el escozor, fotofobia, secreción acuosa, hiperemia conjuntival bulbar y reacción folicular en conjuntiva tarsal superior e inferior, y a menudo, presencia de una adenopatía preauricular, palpable y dolorosa a la presión4.
En el caso que presentamos hemos utilizado una nueva propuesta de protocolo terapéutico para las “infecciones adenovíricas en el adulto”5. En el mismo incluimos desde la primera visita tratamiento tópico con Povidona Iodada (PI) (solución 0.6% – IODIM® multidosis, Angelini Pharma, Ancona, Italia), y Corticoesteroides (CE) (hidrocortisona 3.35 mg/ml – Softacort® monodosis, Thea, Clermont-Ferrand, Francia): Protocolo PICE. La dosificación de la combinación es cada 8 horas 7 días seguido de cada 12 horas 7 días.
Caso clínico
Mujer de 52 años de edad que visita nuestra clínica en enero de 2021 porque presenta desde hace 3 días molestias en ojo derecho (OD), sin dolor, edema moderado de párpados, fotofobia importante, hiperemia conjuntival, lagrimeo, escasa secreción “purulenta”, visión borrosa, sin linfadenopatía preauricular; a las 48 horas presenta la misma clínica en el ojo izquierdo (OI). Trabaja como auxiliar de clínica en un centro asistencial público, y un compañero tiene los mismos síntomas oculares. No ha realizado tratamiento específico. Realiza tratamiento ocasional para “blefaritis y ojo seco moderado”.
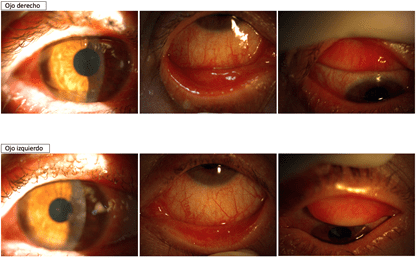
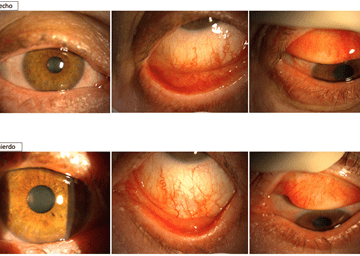
En la exploración se observa en ambos ojos (AO) clínica de QCE, más acentuada en OI, sin presencia de seudomembranas (SM), moderada queratopatía punteada (QP), y si algunos infiltrados subepiteliales (ISE) en OI (fig. 1). Se prescribe el protocolo PICE. A las 48 horas presenta remisión parcial de la clínica de AO, no observándose los ISE en OI (fig. 2). Refiere buena tolerancia al IODIM®. Continúa con el mismo tratamiento hasta completar 7 días, observándose mejoría progresiva de la clínica de AO (fig. 3). Se indica seguir con el protocolo PICE 7 días más con dosificación cada 12 horas.
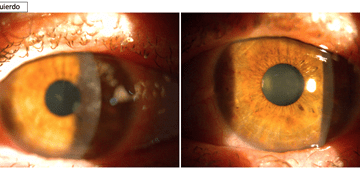
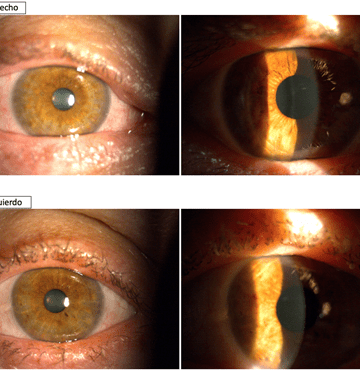
En la última visita presenta una exploración conjuntival y corneal normal en AO, una AVMC de la unidad en AO, y una presión intraocular (PIO9 de 15.5 y 16.4 mmHg en OD/OI respectivamente (Icare® PRO, Icare, Finlandia) (fig. 4). La paciente es dada de alta con indicación de utilizar gotas oftálmicas a demanda conteniendo ácido hialurónico reticulado (AH) y coenzima Q10 (CoQ10) (VisuXL® multidosis, VISUfarma BV, Amsterdam, The Netherlands). No ha tenido recidiva durante los 7 meses de seguimiento.
Discusión
El diagnóstico de la QCE es clínico; a veces están indicados los cultivos celulares/frotis conjuntivales ante una evolución tórpida de la enfermedad. También está disponible la prueba de reacción en cadena de la polimerasa (PCR). Aunque los primeros estudios de las pruebas rápidas de antígenos para adenovirus en el consultorio informan una sensibilidad del 89% y hasta un 94% de especificidad1, los resultados de estudios más recientes apuntan hacia una alta especificidad, pero solo una sensibilidad moderada que varía de 39,5% a 50%6. En consecuencia, se aconseja que los resultados negativos con el kit AdenoPlus® (Nicox Inc., Dallas), se confirmen mediante PCR en tiempo real debido a su elevada sensibilidad7.
El tratamiento de la QCE actualmente no dispone de fármacos específicos. Como coadyuvante a la higiene proceden las medidas sintomáticas: aplicación de compresas frías, lubricantes oculares, y corticoides tópicos de existir fotofobia intensa o deterioro de la visión. Al tratarse de una infección extremadamente contagiosa, desde un principio y durante un mínimo de 2 semanas, los pacientes deben permanecer aislados tanto a nivel familiar, social, y especialmente laboral8,9. Los dispositivos médicos tienen especial relevancia como vectores de contagio10.
Se han propuesto tratamientos tópicos especialmente para prevenir las posibles secuelas con antivirales11. La actuación farmacológica utilizando inmunosupresores tópicos mayormente está supeditada al tratamiento de los infiltrados corneales subepiteliales12-14.
Berkelman et al.,15 en un estudio de laboratorio observan que las concentraciones bajas de PI proporcionaban niveles más altos de iodo libre, lo que se podría traducir en una mayor actividad bactericida. Silas et al.16, realizan un estudio experimental comparando la eficacia de diferentes concentraciones de PI (10.0% – 0.1%), y concluyen que la concentración al 1.0% aplicada cada 30 segundos 3 veces tiene la misma equivalencia antiséptica preoperatoria que la concentración al 5.0%. Recientemente, Reibaldi et al.,17 publican los resultados de un estudio realizado en pacientes que iban a recibir tratamiento con anti-VEGF utilizando como antiséptico un colirio de PI 0.6% sin conservantes durante los 3 días previos, observando una eficacia de esta en la reducción de la carga bacteriana conjuntival de un 82% respecto al grupo control. En la última década asistimos a la aparición de evidencias cada vez más sólidas que sugieren que el uso de PI por vía tópica en las CA podría acortar de forma muy significativa la duración del cuadro clínico18, y reducir la probabilidad de que el paciente desarrolle complicaciones19.
Las propuestas de asociar a la PI corticosteroides tópicos -dexametasona- son relativamente recientes20-23. La administración oral de un suplemento nutricional conteniendo antioxidantes y ácidos grasos Omega-3 (AOX/ω-3), por su acción antiinflamatoria, ha sido propuesto como coadyuvante del tratamiento farmacológico instaurado por Pinazo-Durán y cols.,24.
El protocolo PICE se compone de PI al 0,6% y de hidrocortisona, entendiendo que esta última posee menor potencia relativa, menor penetración, y una acción más corta que la dexametasona25, pero suficiente para tratar el componente inflamatorio asociado a las CA, disminuyendo el riesgo de complicaciones como la hipertensión ocular (HTO) o descompensación de un glaucoma previamente diagnosticado, como ocurrió en nuestro caso.
En nuestra paciente destaca la buena evolución de la clínica inicial utilizando el protocolo PICE, resultando especialmente llamativo la resolución a las 48h de su inicio de los ISE que presentaba en el OI. Esto hace suponer que la PI de alguna manera interfiere la replicación de los adenovirus como sugieren Pelletier et al.,26. Grzybowski et al.,27 evalúan el uso de PI en oftalmología, y consideran entre sus diferentes indicaciones el tratamiento de las CA.
Consideraciones finales
El uso de PI a baja concentración previene la sobreinfección bacteriana o la trata de existir previamente, evitando el consumo de antibióticos y la posible aparición de resistencia a los mismos.
En nuestro caso no hemos observado intolerancia al preparado IODIM® multidosis posiblemente debido a su composición (triglicéridos de cadena media (MCT), hialuronato sódico, glicerol, vitamina E TPGS, citrato de potasio tribásico, cloruro sódico, ácido cítrico monohidrato, povidona iodada 0.6% y agua purificada).
El protocolo PICE puede ser el primer escalón terapéutico en las CA incluyendo la QCE, reduciendo el tiempo de enfermedad y las posibles secuelas funcionales. La disponibilidad y asequibilidad de sus componentes permite una actuación precoz en pacientes con clínica de CA, y de todo su entorno con clínica similar, sin necesidad de estudios específicos de identificación viral.
BIBLIOGRAFÍA
- Azari AA, Barney NP. Conjunctivitis: a systematic review of diagnosis and treatment. JAMA. 2013; 310: 1721-9.
- Jhanji V, Chan TC, Li EY, Agarwal K, Vajpayee RB. Adenoviral keratoconjunctivitis. Surv Ophthalmol. 2015; 60 :435–443.
- Kuo IC. Adenoviral keratoconjunctivitis: diagnosis, management, and prevention. Curr Ophthalmol Rep. 2019; 7: 118–127.
- Enfermedades de la conjuntiva, esclerótica, iris, anexos. En: Manual de Oftalmología del Wills Eye Hospital. 7ª edición 2016. Editores: Bagheri N, Wajda BN. Wolters Kluver ISBN: 978-1-4963-1883-1. Philadelphia. Pag. 104.
- Abreu JA, Abreu R. Povidona iodada 0.6% más hidrocortisona en el tratamiento de la queratoconjuntivitis epidémica: nuestra experiencia con el protocolo PICE. ARCH. SOC. CANAR. OFTAL., 2021; 32: 119-128.
- Kam KY, Ong HS, Bunce C, Ogunbowale L, Verma S. Sensitivity and specificity of the AdenoPlus point-of-care system in detecting adenovirus in conjunctivitis patients at an ophthalmic emergency department: a diagnostic accuracy study. Br J Ophthalmol. 2015; 99: 1186–1189.
- Azari AA, Arabi A. Conjunctivitis: A Systematic Review. J Ophthalmic Vis Res. 2020; 15: 372-395.
- Dart JK, El-Amir AN, Maddison T, Desai P, et al. Identification and control of nosocomial adenovirus keratoconjunctivitis in an ophthalmic department. Br J Ophthalmol. 2009; 93: 18-20.
- Varu DM, Rhee MK, Akpek EK, Amescua G, Farid M, Garcia-Ferrer FJ, et al. Conjunctivitis preferred practice pattern®. Ophthalmology. 2019.
- Junk AK, Chen PP, Lin SC, Nouri-Mahdavi K, Radhakrishnan S, Singh K, et al. Disinfection of Tonometers: a report by the American Academy of Ophthalmology. Ophthalmology. 2017; 124: 1867–1875.
- Hillenkamp J, Reinhard T, Ross RS, Böhringer D, Cartsburg O, Roggendorf M, et al. The effects of cidofovir 1% with and without cyclosporin a 1% as a topical treatment of acute adenoviral keratoconjunctivitis: a controlled clinical pilot study. Ophthalmology. 2002; 109: 845–50.
- Levinger E, Slomovic A, Sansanayudh W, Bahar I, Slomovic AR. Topical treatment with 1% cyclosporine for subepithelial infiltrates secondary to adenoviral keratoconjunctivitis. Cornea. 2010; 29:638–640.
- Ghanem RC, Vargas JF, Ghanem VC. Tacrolimus for the treatment of subepithelial infiltrates resistant to topical steroids after adenoviral keratoconjunctivitis. Cornea. 2014;3 3: 1210–1213.
- Berisa-Prado S, Riestra-Ayora AC, Lisa-Fernandez C, Chacon-Rodriguez M, Merayo-Lloves J, Alfonso-Sanchez JF. Topical tacrolimus for corneal subepithelial infiltrates secondary to adenoviral keratoconjunctivitis. Cornea. 2017; 36: 1102–1105.
- Berkelman RL, Holanda BW, Anderson RL. Increased bactericidal activity of dilute preparations of povidone-iodine solutions. J Clin Microbiol. 1982;15: 635-9.
- Silas MR, Schroeder RM, Thomson RB, Myers WG. Optimizing the antisepsis protocol: effectiveness of 3 povidone-iodine 1.0% applications versus a single application of povidone-iodine 5.0%. J Cataract Refract Surg. 2017; 43: 400-404.
- Reibaldi M, Avitabile T, Bandello F, Longo A, et al. The Effectiveness of 0.6% Povidone Iodine Eye Drops in Reducing the Conjunctival Bacterial Load and Needle Contamination in Patients Undergoing Anti-VEGF Intravitreal Injection: A Prospective, Randomized Study. J Clin Med. 2019. 13; 8:1031.
- Trinavarat A, Atchaneeyasakul LO. Treatment of epidemic keratoconjunctivitis with 2% povidone-iodine: a pilot study. J Ocul Pharmacol Ther. 2012 ;28: 53–58.
- González-Martín-Moro J, Zarallo-Gallardo J. Povidona yodada. ¿Un nuevo paradigma en el tratamiento de la conjuntivitis adenovírica? (Editorial). Arch Soc Esp Oftalmol.2019; 94: 521-522.
- Clement C, Capriotti JA, Kumar M, et al. Clinical and antiviral efficacy of an ophthalmic formulation of dexamethasone povidone-iodine in a rabbit model of adenoviral keratoconjunctivitis. IOVS. 2011; 52: 339-344.
- Pinto RD, Lira RP, Abe RY, Fernandes-Felix JP, Fernandes-Pereira AV, Leite-Arieta CE, et al. Dexamethasone/povidone eye drops versus artificial tears for treatment of presumed viral conjunctivitis: a randomized clinical trial. Curr Eye Res. 2015; 40: 870–877.
- Kovalyuk N, Kaiserman I, Mimouni M, Cohen O, Levartovsky S, Sherbany H, et al. Treatment of adenoviral keratoconjunctivitis with a combination of povidone-iodine 1.0% and dexamethasone 0.1% drops: a clinical prospective controlled randomized study. Acta Ophthalmol. 2017; 95: 686–e692.
- Pepose JS, Ahuja A, Liu W, Narvekar A, Haque R. Randomized, controlled, phase 2 trial of povidone-iodine/dexamethasone ophthalmic suspension for treatment of adenoviral conjunctivitis. Am J Ophthalmol. 2019; 205:197.
- Pinazo-Durán MD, García -Medina JJ. Queratoconjuntivitis adenovírica. 1ª edición 2020. ISBN: 978-84-09-20576-9. Barcelona. Pag. 6.
- Gil-Ruiz MR, Cortés-Valdés C. Farmacología de la inflamación y analgesia en oftalmología. En: Farmacología Ocular. 1ª edición 2007. Sociedad Española de Oftalmología. ISBN: 978-84-89085-33-6. Madrid. Pag. 168-169.
- Pelletier JS, Stewart K, Trattler W, Ritterband DC, Braverman S, Samson CM, et al. A combination povidone-iodine 0.4%/dexamethasone 0.1% ophthalmic suspension in the treatment of adenoviral conjunctivitis. Adv Ther. 2009; 26: 776–83.
- Grzybowski A, Kanclerz P, MyersWG. The use of povidone-iodine in ophthalmology. Curr Opin Ophthalmol. 2018; 29: 19-32.













