Por Christine Yue Leonard, editora asociada sénior
Así es como los especialistas están utilizando los últimos tratamientos para DMAE húmeda, EMD y OVR.
En el espacio de unos pocos años se han aprobado varios tratamientos retinianos nuevos para la degeneración macular húmeda relacionada con la edad, el edema macular diabético y la oclusión de la vena retiniana, lo que promete una mayor durabilidad y un mejor secado. Estas adiciones a la caja de herramientas son alentadoras para el tratamiento de pacientes resistentes y recién diagnosticados.
Así como ocurre con cualquier tratamiento, recientemente disponible, la aceptación suele ser gradual y los médicos pueden preguntarse si vale la pena adquirir otro medicamento. Aquí, los especialistas en retina comparten cómo se están desempeñando estos nuevos medicamentos en la clínica y qué tratamientos en investigación son prometedores.
Durabilidad biespecífica
La aceptación del Faricimab-svoa (Vabysmo, Genentech) ha aumentado desde su aprobación por la FDA en el año 2022, a medida que los especialistas en retina se han familiarizado con el nuevo medicamento y su durabilidad. El faricimab bloquea VEGF-A y Ang-2 para reducir la inflamación adicional y la fuga vascular mediante la estabilización de los vasos sanguíneos.
“Los ensayos clínicos tanto para la DMAE húmeda como para el EMD suponen que el faricimab funciona al menos bien visualmente y parece secar un poco mejor y más rápido que los medicamentos más antiguos”, dice Carl Regillo, MD, jefe del servicio de retina del Wills Eye Hospital, en Filadelfia. “Para algunos pacientes, esto puede traducirse en mejores resultados. El faricimab parece ser más resistente y duradero; lo vemos a medida que cambiamos al faricimab a los pacientes que toman anti-VEGF más antiguos o de primera generación”.
Los especialistas dicen que este medicamento se puede usar como tratamiento de primera línea y en pacientes que son resistentes o difíciles de tratar. “Me gustaría usarlo más a menudo como una opción de primera línea; sin embargo, la realidad es que suele haber problemas con los pagadores, que exigen el uso de medicamentos más antiguos primero; típicamente, políticas de “el bevacizumab, primero”, dice el Dr. Regillo. “Determinan usar el ranibizumab o el aflibercept antes de que podamos llegar al faricimab. Normalmente, hay muchos trámites en el manejo del reembolso de los pagadores, lo que retrasa la utilización de los medicamentos más nuevos en general”.
David S. Boyer, MD, de Retina-Vitreous Associates Medical Group, en Los Ángeles, dice que ha tenido “una experiencia mixta” con el faricimab. “Pude secar mejor a algunos pacientes y aplazar un poco más a otros. Y como tengo a pacientes en los que no parecía haber mucha diferencia, opté por volver al paradigma de tratamiento anterior que estaba usando, generalmente Eylea en ese momento”.
“Comenzamos a cambiar al faricimab a algunos de nuestros pacientes que habían tomado aflibercept durante muchos años, así como a algunos de nuestros pacientes resistentes”, dice Jay Chhablani, MD,
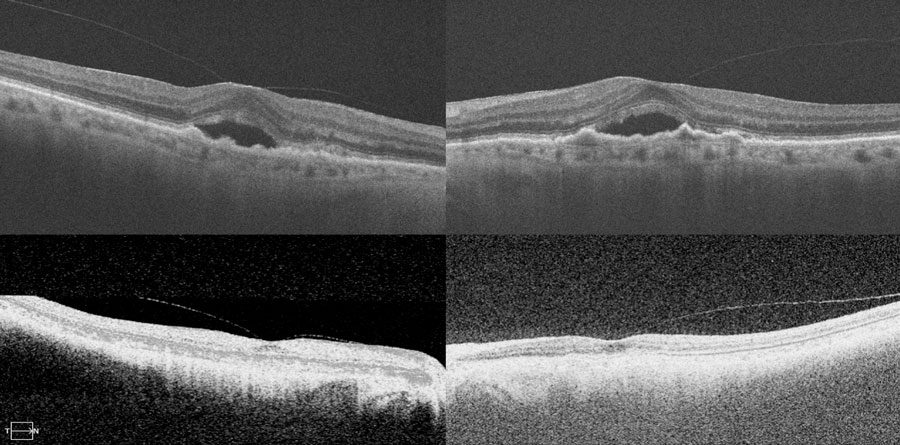
profesor de oftalmología en la Facultad de Medicina de la Universidad de Pittsburgh. “También ofrezco faricimab a mis casos sin experiencia previa de tratamiento. He visto a muchos pacientes tener buena respuesta (ver la figura). Algunos de los pacientes que eran resistentes a otros medicamentos pueden mantenerse con el faricimab mensual. A otros, les he cambiado para cada tres o cuatro meses”.
El Dr. Chhablani utiliza una combinación de telemedicina y visitas al consultorio para seguir a los pacientes recién cambiados al faricimab. “Si veo que después de una o dos inyecciones la respuesta es buena, puedo incorporar algunas citas de telemedicina”, dice. “Dado que ha cambiado a un nuevo medicamento, no sé cuál podría ser el intervalo exacto sin tratamiento; así que, a ese paciente le digo ‘que responde muy bien al tratamiento, por ello saltaré su inyección hoy, y que me gustaría obtener una OCT y usar la telemedicina en cuatro semanas’. Esto me da la confianza de no ponerle la inyección y, al mismo tiempo, vigilar de cerca cualquier recurrencia temprana. Una vez que comprobamos que al paciente le va bien, digamos, a las 12 semanas, aplazo su próxima visita para cuatro semanas, con una visita de telemedicina, y amplio el intervalo máximo sin tratamiento.”
“Estos son los pacientes que estaban acostumbrados a recibir inyecciones mensuales”, continúa. “No quiero perder su confianza haciéndoles sentirse como si no los estuviera siguiendo tan a menudo o cuidando tan de cerca como antes. Agregar la telemedicina es una buena combinación en la que puedo asegurarme de que están sintomáticamente estables, poniéndoles la inyección con menos frecuencia. Si hay algún cambio en la visión o síntomas en su visita solo de prueba, nuestros técnicos saben que deben hacer la autofluorescencia y las fotos del fondo de ojo, e informar al proveedor de servicios de salud inmediatamente”.
Los ensayos clínicos y la experiencia en el mundo real hasta ahora han demostrado que el perfil de seguridad del faricimab es comparable al del ranibizumab o el aflibercept. “No se relacionaron eventos adversos únicos al faricimab, y su perfil de seguridad es similar al que hemos usado”, dice el Dr. Regillo. “Es muy bien tolerado”. Los estudios de extensión AVONELLE-X (NCT04777201, n=1,036) y RHONE-X (NCT04432831, n=1,479) para la DMAE húmeda y el EMD, respectivamente, están en curso para evaluar la seguridad y tolerabilidad a largo plazo.
Biosimilares
Los biosimilares de ranibizumab han tenido una aceptación lenta, con la oferta de medicamentos más nuevos y duraderos, como el faricimab, y los probados y verdaderos anti-VEGFs originales. Sin embargo, los especialistas dicen que el uso de biosimilares probablemente se expandirá a medida que los pagadores los incorporen en la terapia escalonada. El ranibizumab-nuna (Byooviz, Biogen) y el ranibizumab-eqrn (Cimerli, Coherus Biosciences) están disponibles en los Estados Unidos desde el año 2022, aunque solo el ranibizumab-eqrn se considera intercambiable con Lucentis.
“Los biosimilares no ofrecen ninguna ventaja clínica sobre los productos de referencia”, dice el Dr. Regillo. “La única razón para usarlos sería para ahorrar costos, y eso suele ser un ahorro por parte del pagador (algunos pueden exigir el uso de un biosimilar); ya si un paciente tiene que pagar de su bolsillo, es posible que prefiera algo que cueste menos. Es bastante inusual que un paciente tenga que asumir el costo total de estos medicamentos, pero ocasionalmente puede suceder.”
El Dr. Chhablani está de acuerdo en que la aceptación del biosimilar probablemente vendrá menos del lado del proveedor y más del pagador. “Creo que los pagadores nos van a empujar a facturar los biosimilares, ya que el costo será más barato en comparación con las moléculas originales”, dice. “¿Cuánto tiempo nos llevará llegar a eso, en que no estamos usando la molécula original, sino biosimilares? Creo que los biosimilares tienen algo de espacio; pero, teniendo en cuenta que hay tantos nuevos medicamentos disponibles y que llegan pronto, creo que lo pasarán mal.”
El Dr. Boyer señala que hoy en día hay menos pacientes tomando Lucentis, ya que Eylea y Vabysmo están disponibles. “Hay un número limitado de objetos que uno puede llevarse en su maleta”, dice el Dr. Boyer. “Si lleva Lucentis, Vabysmo, Eylea y Avastin, el espacio para los biosimilares queda limitado. Pero, esto puede cambiar cuando salgan los biosimilares del aflibercept, ya que los especialistas en retina están muy familiarizados y lo usan con frecuencia”.
Los biosimilares del aflibercept en la fase III incluyen el SOK583A1 (Sandoz), el CT-P42 (Celltrion Healthcare) y el ALT-L9 (Alteogen).
Es posible que en los próximos años aparezca otro biosimilar de ranibizumab en el arsenal. La FDA aceptó la solicitud de licencia de productos biológicos suplementaria para el XSB-001 (Xlucane, Xbrane Biopharma) el 21 de junio de 2023. La fecha objetivo de la enmienda de la tarifa de usuario de biosimilares (BsUFA, por sus siglas en inglés) es el 21 de abril de 2024.
“Creo que eventualmente habrá la aceptación de los biosimilares”, dice el Dr. Chhablani. “La oncología está totalmente basada en biosimilares y lleva años usándolos. Creo que probablemente sea la hora de que también aceptemos esto como una forma de tratar a nuestros pacientes.”
Inyección supracoroidal
En 2021, la FDA aprobó la primera suspensión inyectable de acetónido de triamcinolona supracoroidal (Xipere, Clearside Biomedical/Bausch + Lomb) para el edema macular asociado con la uveítis. El Dr. Chhablani dice que “Xipere ha tenido un buen desempeño en muchos de nuestros pacientes. Aún no hemos visto los resultados a largo plazo, pero los a corto plazo son prometedores. He visto a pacientes de hasta cuatro o cinco meses”.
“La inyección de Xipere tiene una curva de aprendizaje corta y no es una inyección difícil de administrar, aunque es un poco más laboriosa que otras para preparar e inyectar, si uno no está acostumbrado a hacerlo”, dice el Dr. Boyer. “Afortunadamente, estuve involucrado en los estudios que utilizaron esta técnica. Es bastante cómodo para los pacientes”.
La empresa ofrece capacitación para usar su microinyector para el espacio supracoroidal. El entrenamiento incluye un kit con una jeringa de práctica y un ojo sintético.
Brolucizumab con cautela
El brolucizumab-dbll (Beovu, Novartis) es un fragmento variable monocatenario monoclonal humanizado que inhibe el VEGF-A para disminuir la neovascularización. Recibió la aprobación de la FDA para la DMAE húmeda en 2019 y para el EMD en 2022.
“El brolucizumab no se usa tanto porque su perfil de seguridad no es tan bueno como el de todos los demás agentes que hemos usando o los aprobados recientemente”, explica el Dr. Regillo. “Tiene altas tasas de inflamación intraocular y algunos eventos adversos únicos, como vasculitis retiniana y oclusiones retinianas relacionadas con la vasculitis. Eso no es algo que hayamos visto con otros anti-VEGF ni con el faricimab hasta la fecha. Estas preocupaciones de seguridad adicionales han frenado considerablemente la aceptación y utilización del brolucizumab desde su aprobación por la FDA.”
Algunos especialistas en retina dicen que no usan el brolucizumab en absoluto; otros, solo en raras circunstancias. El Dr. Boyer dice que el brolucizumab es el fármaco más fuerte que había usado, y es el último que consideraría utilizar debido a su perfil de seguridad. “Secó fenomenalmente bien y funcionó en pacientes a los que antes no podía secar en absoluto”, dice. “Pero, debido a sus efectos secundarios que amenazan la visión, está reservado para pacientes que son muy difíciles de tratar. Solo me queda un paciente que toma brolucizumab, y al que previamente le han fallado todos los demás tratamientos anti-VEGF. Así que es un gran medicamento, pero, desafortunadamente, su perfil de efectos secundarios limita su uso a casos raros. Llamaría esto de un medicamento de cuarta línea, especialmente en vista de la mejora del faricimab en el secado general”.
Al igual que con cualquier medicamento anti-VEGF, los pacientes que toman brolucizumab deben ser seguidos cuidadosamente para detectar cualquier signo de inflamación, especialmente después de los primeros tratamientos, dice el Dr. Regillo. “Si hay alguna inflamación, no se debe usarlo. Es muy probable que si un paciente tiene alguna inflamación, sea más propenso a sufrir más inflamación, lo que podría tener un efecto grave si se reintroduce el medicamento”.
Aflibercept de dosis alta
El aflibercept 8 mg es una nueva formulación intravítrea en una inyección de 70 µL (114.3 mg/mL) que ofrece una dosis molar cuatro veces mayor en comparación con el aflibercept 2 mg. Se plantea la hipótesis de que este aumento de la dosis proporciona una concentración vítrea efectiva más prolongada y una señalización de VEGF de efecto más sostenido.
Los especialistas en retina tendrán que esperar un poco más por el tan esperado aflibercept 8 mg. A finales de junio, debido a resultados insatisfactorios de inspección en un excipiente de un tercero, se pospuso la aprobación de la dosis de 8 mg. Afortunadamente, no se encontraron problemas con la eficacia clínica, la seguridad, el diseño de prueba, el etiquetado o la fabricación del aflibercept 8 mg, y la FDA no solicitó datos adicionales.
“El aflibercept de dosis altas ha demostrado una mayor durabilidad y un mejor secado en sus estudios de fase III para la DMAE húmeda y el EMD”, dice el Dr. Regillo. “Parece ser que ofrecería beneficios similares a los que ha proporcionado el faricimab hasta ahora. Se espera su aprobación por parte de la FDA para ambas indicaciones en un futuro muy cercano. Una vez que eso suceda, será otra buena opción para nuestros pacientes.”
A finales de junio, Regeneron también publicó los datos principales de dos años del ensayo pivotal de PHOTON para el EMD. Los pacientes en el ensayo fueron aleatorizados a intervalos de dosificación de 12 semanas (n=328) o 16 semanas (n=163) después de tres dosis mensuales iniciales con flexibilidad de dosificación, si se cumplían ciertos criterios, o el aflibercept 2 mg dosificado cada ocho semanas (n=167). La empresa informa que el 89% de los pacientes mantuvo la dosificación ≥12 semanas durante el período de dos años, el 83% mantuvo la dosificación ≥16 semanas y el 43% cumplió con los criterios de la dosificación ≥20 semanas en la semana 96.
En comparación con el régimen on-label, el aflibercept 8 mg dosificado cada 12 o 16 semanas redujo el número promedio de inyecciones a los dos años (13,8 inyecciones frente a 9,5 y 7,8 inyecciones, respectivamente). La mejora media de la AVMC fue comparable entre los regímenes de dosis altas
on-label y los de 12 y 16 semanas (aumentos de 8,4, 8,8 y 7,5 letras, respectivamente).
Se informaron datos de seguridad consistentes con los del aflibercept 2 mg. Los eventos adversos oculares más comunes fueron cataratas, moscas volantes vítreas y hemorragia conjuntival. No se produjeron casos de vasculitis retiniana, retinitis oclusiva ni endoftalmitis. La tasa de inflamación intraocular fue del 1,2% para los grupos de 2 mg y 8 mg.
En los datos de un año del ensayo PULSAR para la DMAE húmeda, el 79% de 316 pacientes mantuvieron la dosificación de 12 semanas y el 77% de 312 pacientes mantuvieron la dosificación de 16 semanas. La AVMC no fue inferior para el aflibercept 2 mg. Al año, los pacientes que recibieron el aflibercept on-label recibieron un promedio de 6,9 inyecciones, en comparación con 6,1 y 5,2 inyecciones para la dosificación de 12 y 16 semanas, respectivamente.
Además, el 69% de los pacientes de 8 mg no tenían fluido central en el subcampo al año en comparación con el 59% de los pacientes de 2 mg. Se logró un subcampo central libre de fluido en una mediana de ocho semanas para los pacientes on-label y de cuatro semanas para los pacientes de 8 mg. La seguridad fue consistente con la dosis de 2 mg. Se esperan datos de PULSAR de dos años sobre el aflibercept 8 mg para la DMAE húmeda, en el tercer trimestre de 2023.
El Dr. Regillo especula que cuando se introduzca por primera vez, el aflibercept de dosis altas experimentará una adopción gradual a lo largo del tiempo, como el faricimab. “Creo que a medida que los especialistas en retina se familiaricen con el medicamento y ‘prueben el terreno’, por así decirlo, comenzarán a usarlo para una combinación de DMAE húmeda y EMD, tanto la establecida como la de nueva aparición”, dice.
“La pregunta que queda es si los especialistas en retina dejarán el aflibercept 2 mg por el aflibercept de dosis altas o el faricimab”, señala el Dr. Chhablani. “Algunos pueden querer cambiar a los pacientes resistentes a una molécula diferente en lugar de inyectarles la misma molécula. También puede haber pacientes que no responden al faricimab a los que podríamos considerar ofrecer el aflibercept de dosis altas”.
“El costo representa una gran diferencia”, dice el Dr. Boyer. “No sé qué hará la compañía con la dosis de 2 mg, especialmente a la luz del hecho de que los biosimilares del aflibercept 2 mg saldrán pronto. Diría que dependiendo del costo del biosimilar y el costo de la dosis de 8 mg, puede haber algunos planes de seguro que mantendrían a los pacientes en la dosis de 2 mg en lugar de subirlos a la dosis de 8 mg. Eso tendrá que desarrollarse en el mercado”.
Los especialistas en retina tienen esperanzas sobre la mayor durabilidad del 8 mg, pero tienen en cuenta que el intervalo en el mundo real puede ser un poco más corto. “Cada vez que se realiza un ensayo clínico, el objetivo es asegurarse de no dejar la visión sobre la mesa en comparación con los comparadores disponibles en ese momento”, dice el Dr. Boyer. “Siempre hay criterios de rescate para algún grado de fluido o grado de pérdida, o se debe cumplir una combinación antes del retratamiento. En manos de los especialistas en retina, normalmente no toleramos ningún fluido. Entonces, creo que no podremos extenderlo tanto como dicen los anuncios, al igual que no voy a acoger el faricimab del mismo modo como dicen los anuncios porque no tolero ningún fluido en el tratamiento de la DMAE húmeda o la retinopatía diabética. Creo que el aflibercept 8 mg extenderá un poco el intervalo de tratamiento; pero hasta qué punto, aún no lo sabemos”.
¿Qué hay en la fase III?
Le damos un panorama de algunos posibles nuevos tratamientos que se están preparando:
- OCS-01 (Oculis). El primer tratamiento no invasivo para el EMD puede llegar en los próximos años con las gotas oftálmicas de dexametasona en investigación de Oculis. En el ensayo de fase III (DIAMOND – DIAbetic Macular edema patients ON a Drop), los pacientes fueron aleatorizados 2:1 a OCS-01 (n=100) o vehículo (n=48) seis veces al día para una fase de carga de seis semanas, y tres veces al día para una fase de mantenimiento de seis semanas. Los resultados principales de la etapa uno del ensayo mostraron un aumento estadísticamente significativo en la agudeza visual en la semana seis, en comparación con el vehículo (7,2 frente a 3,1 letras, p=0.007), que se prolongó hasta la semana 12 (7.6 frente a 3.7 letras, p=0.016). Más pacientes lograron un aumento ≥15 letras (27,4% frente a 7,5% en la semana 12, p=0,009) y mejoras en el espesor de la retina (-61,6 µm frente a -16 µm en la semana 12, p=0,004), en comparación con el vehículo. No se observaron eventos adversos inesperados. La segunda etapa de DIAMOND, que se espera que comience en la segunda mitad de 2023, incluirá dos ensayos globales, cada uno con aproximadamente de 350 a 450 pacientes.
“Los ensayos de fase II mostraron buenos resultados frente a Lucentis”, dice el Dr. Chhablani. “Habrá algunas críticas sobre un comparador de Lucentis, ya que ahora se inician más pacientes con Eylea para EMD; pero si funciona, este método de administración podría ser un muy buen paso adelante para muchas enfermedades. Una cosa importante a considerar es cómo los especialistas en retina aceptarían esta opción: como una combinación con la terapia intravítrea como mantenimiento o como terapia primaria.”
- OPT-302 (Opthea). OPT-302 es una molécula “trampa” de VEGF-C/-D altamente específica, primera en su clase, en desarrollo para la DMAE húmeda, que se utilizará junto con el ranibizumab. Ha recibido de la FDA la designación de vía rápida.
El Dr. Boyer señala que “se trata de dos inyecciones administradas al mismo tiempo, lo que es un poco menos conveniente que una inyección”; sin embargo, añade que esta nueva molécula podría ayudar a abordar el problema de la taquifilaxia que experimentan algunos pacientes, en que un medicamento funciona bien durante un tiempo y luego, de repente, sus efectos desaparecen.
“La taquifilaxia puede ser secundaria a la regulación positiva del VEGF-C en humanos”, explica.
En el ensayo de fase IIb (n=366), OPT-302 + ranibizumab demostró ganancias estadísticamente significativas en la AVMC, desde el inicio hasta la semana 24, en comparación con la monoterapia con ranibizumab (16.1 frente a 10.3 letras, p=0.0002). Actualmente, Opthea está realizando dos ensayos de registro de fase III de OPT-302 2 mg intravítreo utilizado en combinación con 0,5 mg de ranibizumab o 2 mg de aflibercept a diferentes intervalos, ShORe (NCT04757610, n=990) y COAST (NCT04757636, n=990), respectivamente.
- HLX04-O (Shanghai Henlius Biotech/Essex). Shanghai Henlius Biotech y Essex han desarrollado una versión oftálmica de su biosimilar del bevacizumab (HLX04 [Hanbeitai]), el HXL04-O para la DMAE húmeda. El HLX04-O 1.25 mg/0.05 ml cada cuatro semanas fue bien tolerado en el ensayo de fase I/II (NCT04993352). En febrero, el primer paciente estadounidense recibió una dosis en el ensayo global de fase III (NCT04740671) que compara la eficacia y seguridad del HLX04-O con el ranibizumab. Los pacientes fueron aleatorizados 1:1 para recibir 1,25 mg de HLX04-O ó 0,5 mg de ranibizumab, cada cuatro semanas, durante 48 semanas. La medida de resultado primaria es el cambio medio en la AVMC desde el inicio hasta la semana 36.
- ONS-5010/Lytenava (Outlook Therapeutics). ONS-5010 (bevacizumab-vikg) es una formulación en investigación del bevacizumab en desarrollo para el tratamiento de la DMAE húmeda y otras enfermedades de la retina. En octubre de 2022, la FDA aceptó la presentación de una solicitud de licencia de productos biológicos para la DMAE húmeda. La fecha objetivo de la Prescription User Fee Act es el 29 de agosto de 2023.
El ensayo de fase III NORSE II (NCT03834753, n=288) evaluó la seguridad y eficacia del ONS-5010 dosificado mensualmente en comparación con el ranibizumab dosificado on-label. Se cumplieron todos los criterios de valoración primarios y secundarios: el 41,7% de los pacientes ganaron ≥15 letras de visión (p=0,0052); el 56,5% de los pacientes, ≥10 letras de visión (p=0,0016) y el 68,5%, ≥5 letras (p=0,0116), respectivamente. Un criterio de valoración secundario adicional del cambio medio en la AVMC desde el inicio hasta el mes 11 mostró una ganancia de 11,2 letras con el ONS-5010 en comparación con una ganancia de 5,8 letras con el ranibizumab (p=0,0043). El ONS-5010 fue bien tolerado, con solo un evento adverso inflamatorio ocular que ocurrió en NORSE II y ninguno en NORSE I (un ensayo de experiencia clínica, n=61) o NORSE III (un estudi o de seguridad open-label para la presentación de BLA [NCT04516278], n=197).
“Esta será una opción interesante”, dice el Dr. Chhablani, “pero dependerá mucho de si la empresa es capaz de acercar su costo al de un off-label. Si será más caro, entonces, dudo que cambiemos; especialmente, cuando tenemos datos de seguridad tan sólidos para el bevacizumab off-label que ya abarcan más de dos décadas.”
- KSI-301 (Kodiak Sciences). KSI-301 (tarcocimab tedromer) es un conjugado de biopolímero anti-VEGF en desarrollo para EMD, RD, DMAE húmeda y OVR, que bloquea todas las isoformas de VEGF-A.
El ensayo BEACON de fase III (NCT04592419, n=568) para OVR cumplió con su criterio de valoración primaria de no inferioridad en el cambio medio de la AVMC, con KSI-301 dosificado cada ocho semanas frente al aflibercept dosificado cada cuatro semanas para la ORVR y en todos los pacientes con OVR. Kodiak dice que el KSI-301 es el primer agente anti-VEGF que ha demostrado resultados de agudeza visual comparables a los del aflibercept mensual con la mitad de las dosis. BEACON informó tasas bajas de inflamación intraocular y ningún caso de inflamación intraocular con vasculitis u oclusión vascular.
Otros ensayos de fase III están en curso, y se esperan resultados principales para mediados de 2023 – al momento de escribir este artículo: GLEAM (NCT04611152, n=450) y GLIMMER (NCT04603937, n=450), para EMD; GLOW (NCT05066230, n=253), para RD; y DAYLIGHT (NCT04964089, n=557), para la DMAE húmeda.
El Dr. Boyer es consultor de Regeneron, Genentech/Roche, Oculis SA, Opthea, Novartis, Bausch + Lomb y EyePoint.
El Dr. Regillo es consultor de Regeneron, Genentech/Roche, Kodiak, Novartis, EyePoint y Ocular Therapeutix.
El Dr. Chhablani no tiene relaciones financieras con los productos mencionados en este artículo.












