(Este artículo fue traducido, adaptado e impreso con autorización exclusiva del grupo de revistas de Review de Jobson Medical Information. Su reproducción está prohibida).
Por Liz Hunter, editora sénior
El manejo de pacientes con retinopatía diabética puede ser un desafío. No solo algunos pacientes permanecen asintomáticos y sin darse cuenta del avance de la enfermedad, sino que muchos ni siquiera se someten a exámenes oculares regulares. La retinopatía diabética es la causa número uno de ceguera en adultos estadounidenses de 20 a 74 años, y aunque se recomienda que los diabéticos se hagan exámenes oculares anuales, más del 50% de las personas con RD no reciben las pruebas de detección necesarias.1
Comprender esta población de pacientes es parte integral del tratamiento de su enfermedad, y eso incluye comorbilidades y factores de riesgo que podrían contribuir para su resultado. Hablamos con varios especialistas en retina sobre sus estándares de atención para retinopatía diabética proliferativa específicamente, cómo determinan si un paciente es el más adecuado para la fotocoagulación anti-VEGF o panretiniana y qué sugieren para mejorar la confianza del paciente y el seguimiento.
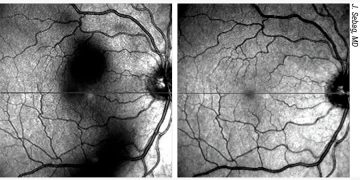
 |
| Figura 1. Imágenes de un paciente varón de unos 30 años con diabetes tipo 2 mal controlada (hemoglobina A1c >12%) y sin atención ocular previa. La angiografía con fluoresceína en la cita inicial mostró áreas extensas de ausencia de perfusión periférica con frondas de neovascularización (se muestra el ojo izquierdo). La OCT mostró edema macular diabético grave que afecta al centro (arriba, a la derecha) que respondió bien a las inyecciones intravítreas de anti-VEGF (aflibercept) (abajo, a la derecha). Un año después de la presentación, tenía 20/20 en ambos ojos con una A1c <7% debido a una mejor adhesión al cuidado de la diabetes y un mejor control sistémico de la glucosa. Foto: Ian C. Han, MD. |
Síntomas de la PRD y cribado
La retinopatía diabética proliferativa (PRD, sigla en inglés) se distingue de la retinopatía diabética no proliferativa en su gravedad. El signo revelador de la PDR es la neovascularización provocada por el control glucémico deficiente, la presión arterial alta, el colesterol alto y otros problemas de salud crónicos. Cuando no se trata, el riesgo de desprendimiento de retina aumenta.
El daño vascular suele ocurrir más en las áreas periféricas de la retina, dice Jason Hsu, MD, codirector de investigación de la retina en Wills Eye Hospital, profesor asistente de oftalmología clínica en el Hospital Universitario Thomas Jefferson, en Filadelfia, y socio gerente de Mid Atlantic Retina.
“Este tipo de paciente puede acudir a su oftalmólogo con pocos o ningún síntoma o, tal vez, solo por un par de gafas y, de paso, descubre que tiene una neovascularización masiva. Su oftalmólogo puede decirle: ‘¡Guau, tiene mucho daño!’ o ’¡Tiene un alto riesgo de perder su visión!’. Y no es raro que no le crea al médico porque su visión sigue siendo bastante buena “, dice. Si se presenta con síntomas, puede incluir la aparición de moscas volantes por alguna hemorragia vítrea. Esos son escenarios muy comunes sobre cómo se diagnostica, por primera vez, a esos pacientes. Otra cosa que puede ocurrirle a todos los diabéticos que tienen retinopatía diabética proliferativa o no proliferativa es el edema macular diabético, y eso causaría un poco más de desenfoque central y también podría ser más sintomático”.
El diagnóstico de pacientes asintomáticos puede tomar un examen cuidadoso, aconseja Ian C. Han, MD, profesor asociado en el departamento de oftalmología y ciencias visuales, en University of Iowa Hospital and Clinics.
“Para mí, la detección todavía comienza con escuchar al paciente y obtener un historial cuidadoso”, dice el Dr. Han. “Por ejemplo, si alguien que acaba de venir para un nuevo examen de la vista, pero ha tenido un diagnóstico de diabetes durante 15 años, su examen inicial ya está alerta a la fuerte posibilidad de PDR. A menudo les digo a los residentes y fellows que asuman por defecto que el paciente tiene PDR, y que se demuestren a sí mismos en el examen clínico que no la tiene; de lo contrario, es posible que no detecten los signos de la enfermedad”.
Diferentes modalidades de imagenología incluyen fotografía basal de fondo de ojo y OCT, así como angiografía con fluoresceína y angiografía con OCT. “La PDR es un poco complicada porque en una OCT es posible que no veamos mucho”, dice el Dr. Hsu.
El Dr. Han está de acuerdo. “Los pacientes con PDR en realidad tienen un fondo de ojo bastante suave; es posible que no veamos una tonelada de hemorragias y demás. En una clínica ocular de rutina podemos ver a un paciente que tiene diabetes mal controlada por 15-20 años y ver una hemorragia puntual aquí o allá asumiéndonos que solo tiene una enfermedad mínima porque la sangre es el hallazgo de fondo de ojo más aparente; sin embargo, de hecho, es una PDR con neovascularización que se pierde”, dice.
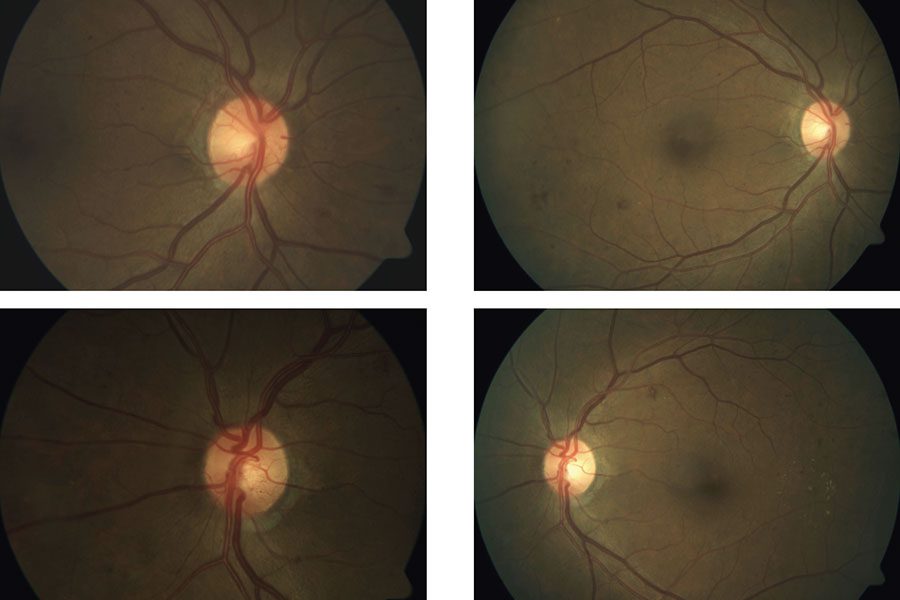 |
| Figura 2. Este paciente presentó PDR en ambos ojos, lo que se muestra en las imágenes del fondo de ojo preoperatoria tomadas en abril de 2017 (columna de la izquierda). Después del tratamiento con anti-VEGF, la PDR ya no aparece en las imágenes del fondo de ojo un mes después (columna de la derecha). Foto: Jennifer I. Lim, MD. |
“Ahora, si se obtiene una OCT de campo más amplio, a veces se puede detectar neovascularización a lo largo de algunas de las arcadas y sobre el nervio óptico”, dice el Dr. Hsu. La neovascularización, a menudo, forma membranas hiperreflectivas, casi como una membrana epirretiniana, pero a veces con una mayor separación por encima del plano de la retina o el nervio óptico. Una cosa a la que es útil prestar atención es la imagen del infrarrojo cercano de la mácula que se utiliza para correlacionar dónde está pasando el corte de la OCT. La neovascularización en la imagen infrarroja cercana, generalmente, se ve oscura y oscurece parte de las arcadas vasculares o el nervio óptico. Si bien eso no es una prueba al 100% de que se trata de neovascularización, puede darle una pista y decirle que lo mire con más cuidado”.
“Con la isquemia y la remodelación vascular, las hemorragias intrarretinianas pueden ser menos prominentes, por lo que los oftalmólogos pueden pasar por alto algunos de los hallazgos más graves o más avanzados que entran en la categoría de la PDR, a menos que estudien los vasos sanguíneos de la retina cuidadosamente en el examen o la imagen”, dice el Dr. Han, con la recomendación de no confiar demasiado en la tecnología para hacer el diagnóstico. “El contexto clínico sigue siendo muy importante. Incluso con la tecnología moderna, algunas anomalías vasculares sutiles pueden no ser tan evidentes, a menos que vaya a buscarlas o estén por debajo de la resolución o la calidad de su imagen”, dice.
Toma de decisiones y discusiones sobre el tratamiento
El tratamiento de la PDR depende de su gravedad. “El láser es la terapia ‘tradicional’ que ha existido durante décadas”, dice el Dr. Hsu. “En este caso, hacemos fotocoagulación panretiniana. Creamos un patrón de láser que está espaciado por aproximadamente un ancho de punto y, generalmente, se mantiene al menos a 1 o 2 diámetros de disco de las arcadas principales y el nervio óptico para no interferir tanto con la percepción del paciente de su visión periférica.” Un estudio del año 1976 fue el primero en mostrar los beneficios de la PCPR para reducir el riesgo de hemorragia vítrea y reducir el riesgo de pérdida de visión en un 50%.2
“Definitivamente, trato de comenzar con la PCPR cuando puedo. Sin embargo, el problema es que, al estar en una práctica de remisión de retina, los pacientes ingresan porque tienen hemorragia vítrea, y en este caso el láser no es efectivo porque la sangre en el vítreo dispersa el rayo láser. Por ello, no se logra obtener una buena absorción”, dice el Dr. Hsu. “En las primeras etapas, el tratamiento es un poco más un juicio clínico, dependiendo de si sentimos que el paciente mantendrá un seguimiento regular. A veces vemos a personas con alguna neovascularización periférica, pero sin hemorragia vítrea ni síntomas. No tenemos que tratar esos ojos de acuerdo con los estudios porque aún podemos tener buenos resultados si esperamos y solo los tratamos cuando se desarrollen características de alto riesgo”.
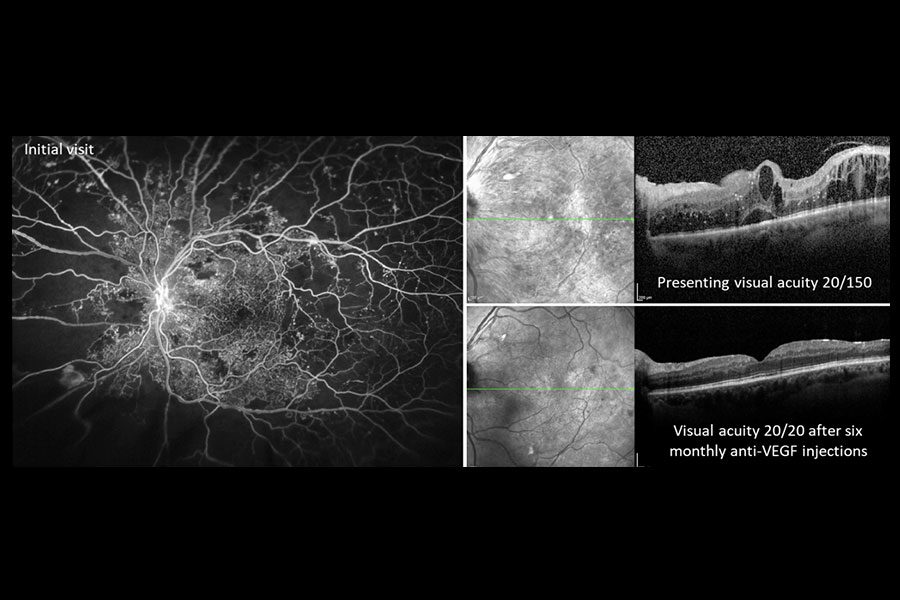
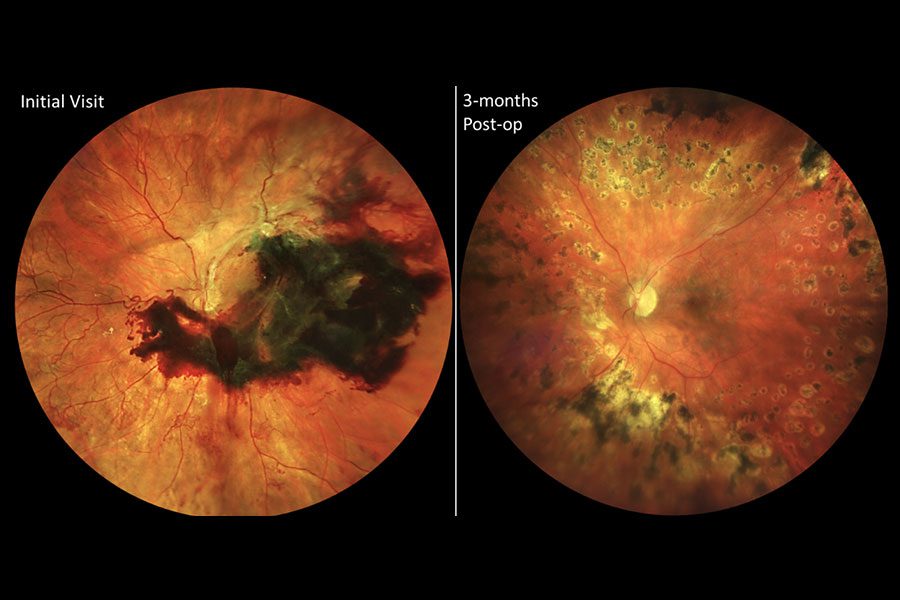 |
| Figura 3. Estas imágenes son de una paciente de unos 30 años de edad con diabetes tipo 1 mal controlada. Debido a los determinantes sociales de salud (p. ej.: transporte limitado) no tenía atención ocular previa y su ojo derecho quedó ciego debido al glaucoma neovascular. Se presentó cuando el ojo izquierdo, con mejor visión, no logró contar la agudeza visual de los dedos debido a una hemorragia subhialoidea y desprendimiento de retina por tracción con neovascularización extensa y de aspecto maduro del disco y en otros lugares (a la izquierda). Después de una vitrectomía rápida con extracción de la membrana y colocación con láser, recuperó una agudeza visual de 20/25 (a la derecha) que ha mantenido durante años de seguimiento posterior. Foto: Ian C. Han, MD. |
Hay efectos secundarios bien conocidos a tener en cuenta con la PCPR, incluida la disminución de la sensibilidad al contraste3, la pérdida de la agudeza visual y la constricción del campo visual periférico.4
“Una de las desventajas del láser que discuto con los pacientes es que puede disminuir la visión periférica e incluso la visión nocturna”, dice el Dr. Hsu. “Eso ha sido bien demostrado porque, esencialmente, se está sacrificando la retina periférica para salvar la retina central. Pero curiosamente, diría que es muy raro que los pacientes se quejen de que perdieron la visión periférica después del láser, porque gran parte de su retina periférica ya es bastante isquémica y, para empezar, no funciona demasiado bien. Tampoco estoy usando una PCPR superpesada, como lo que se pudo haber hecho hace décadas antes de que el anti-VEGF estuviera disponible. Todavía tengo a algunos pacientes a los que se les hizo láser hace 30 o 40 años que están muy bien, con una visión 20/20, pero el láser llega hasta justo afuera de las arcadas. Supongo que tienen un campo de visión mucho más pequeño; sin embargo, no se quejan de ello porque todavía están viendo bien”.
La otra opción de tratamiento es la terapia anti-VEGF. “Anti-VEGF bloquea la vía principal que está llevando al crecimiento neovascular que vemos en la PDR, y eso es bastante sorprendente”, dice el Dr. Hsu. “Por ejemplo, si usted le pone una inyección de un agente anti-VEGF y trae al paciente de vuelta unas horas más tarde o al día siguiente, los vasos a menudo simplemente se derriten muy rápido en respuesta. También es genial que no sea tan destructiva como la PCPR”.
“Cuando empecé en oftalmología, la anti-VEGF era todavía bastante nueva en la práctica clínica rutinaria, y no esperábamos que los pacientes ‘cambiaran el sentido de las cosas’ en términos de la progresión de la enfermedad a la PDR. Todo lo que esperábamos era detener la progresión de la enfermedad “, dice el Dr. Han. “La indicación inicial para la terapia anti-VEGF no era para PDR, sino para edema macular diabético. Por ejemplo, los ensayos clínicos RISE and RIDE con ranibizumab investigaron el efecto de la terapia anti-VEGF en DME, pero sorprendentemente también revirtió la gravedad de la retinopatía diabética para la mayoría de los pacientes. Ahora, la terapia anti-VEGF tiene un sólido historial de funcionar bien y ser eficaz, con la literatura para apoyar múltiples agentes anti-VEGF (bevacizumab [Avastin], ranibizumab [Lucentis], aflibercept [Eylea], etc.) con nuevos medicamentos disponibles (faricimab [Vabysmo]).
El estudio CLARITY, publicado en 2017, comparó el cambio de letra de agudeza visual mejor corregida de un año con los resultados iniciales de los pacientes con PDR tratados con el anti-VEGF aflibercept frente a la PCPR.5 A las 52 semanas, el resultado mostró que aflibercept no era inferior, sino superior a la PCPR (diferencia de agudeza visual media mejor corregida 3,9 letras [IC del 95%: 2,3-5,6], p<0,0001). Este dato respaldó los hallazgos anteriores del ensayo Protocol S, de la Diabetic Retinopathy Clinical Research Network, de 2015, que mostró que el tratamiento con ranibizumab resultó en una agudeza visual que no era inferior a la PCPR tras evaluarla a lo largo de dos años.6
“Este fue un estudio histórico que realmente condujo al cambio de paradigma de hacer anti-VEGF sobre PCPR, porque muestra resultados equivalentes con la terapia anti-VEGF en comparación con PCPR”, dice el Dr. Hsu.
“En los últimos años, el tratamiento para PDR se ha dirigido hacia las inyecciones – ciertamente si hay DME -; también, encontrará un amplia variedad de patrones de práctica para PDR sin DME o solo con complicaciones neovasculares”, dice el Dr. Han. “Creo que eso tiene que ver con lo que uno cree que es el tratamiento más efectivo para el grado o la gravedad de la neovascularización existente. La PDR de ‘alto riesgo’ se definió hace décadas (en el Estudio de Retinopatía Diabética) antes de la terapia anti-VEGF o la cirugía de vitrectomía moderna. Hoy en día, creo que un paciente es de ‘alto riesgo’ basado en determinantes sociales de salud que lo afectan, como si el paciente puede seguir un régimen de tratamiento o aspectos de su enfermedad que pueden causar la pérdida irreversible de la visión, como la tracción que conduce al desprendimiento de retina o el glaucoma neovascular”.
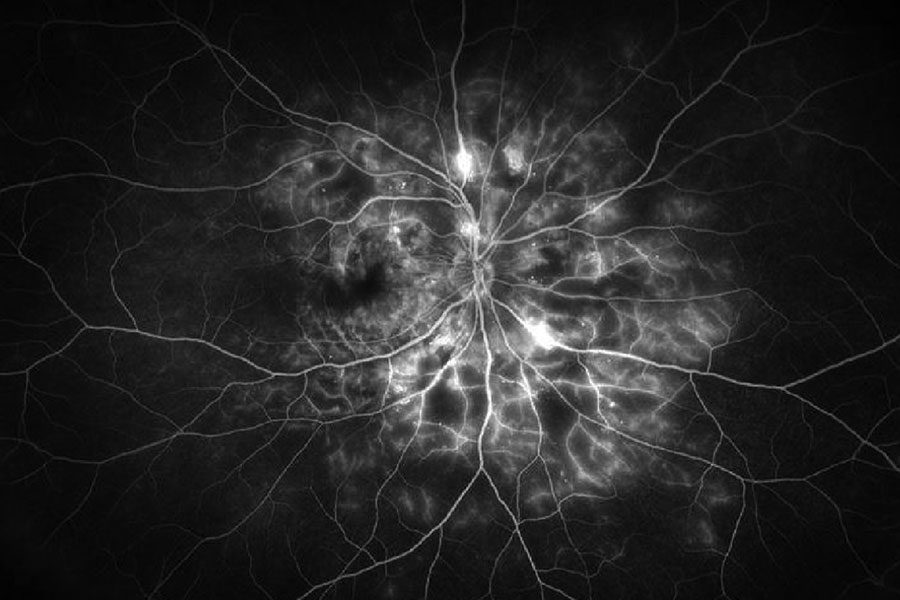 |
| Figura 4. Imagen de angiografía con fluoresceína de campo amplio del ojo derecho de un paciente con retinopatía diabética proliferativa, que muestra áreas hiperfluorescentes de tinción vascular y fuga junto con áreas hipofluorescentes de no perfusión capilar. Foto: Jason Hsu, MD. |
El hecho de que el anti-VEGF funcione tan bien puede ser en detrimento del paciente, añade el Dr. Hsu. “A veces funciona tan bien que el paciente puede pensar: “¡Me ha curado, no necesito volver!” Y verá muy bien, hasta que la próxima hemorragia o algo más le suceda”, dice.
Este es el quid de un debate en curso entre los especialistas en retina. Tanto anti-VEGF como PCPR requieren un seguimiento regular, y teniendo en cuenta la falta de durabilidad de la anti-VEGF, algunos en el campo argumentan que no es lo suficientemente fuerte como tratamiento en solitario.
“Vemos discusiones en las reuniones, en las que hay un ida y vuelta sobre qué tratamiento es mejor; pero, estoy de acuerdo en que el Santo Grial sería llegar a un tratamiento no destructivo”, dice el Dr. Hsu. “Algunos se han aferrado a la anti-VEGF como el tratamiento no destructivo porque la idea es que, como especialistas en retina, queremos preservar el funcionamiento de la retina y no destruirla. Y el concepto de sacrificar la retina periférica para salvar la retina central no es necesariamente atractivo para muchas personas.
“Pero, creo que por otro lado todavía no hemos llegado allí”, continúa el Dr. Hsu. “La era anti-VEGF está aquí, pero la entrega de la misma no es ideal para estos pacientes. Mirando hacia atrás en el Protocolo S, pasaron cinco años en ello y encontraron que con la inyección anti-VEGF los pacientes todavía necesitaban un promedio de tres inyecciones al año. Por lo tanto, no es como si hubiera una cura a largo plazo con la terapia continua anti-VEGF; por lo que sabemos, deben seguir recibiéndola indefinidamente. Si hubiera un tratamiento único que proporcionara un bloqueo anti-VEGF a largo plazo, tal vez este sería el Santo Grial y sería lo suficiente para alejar la aguja del láser, en mi mente. Pero personalmente, creo que aún no estamos allí porque hay demasiado en juego para que estos pacientes no se hagan PCPR”.
También hay algunos beneficios de combinar tratamientos. Una revisión colectiva de estudios del año 2022 que evaluó el impacto de la PCPR y el anti-VEGF para la retinopatía diabética encontró nueve ensayos que muestran que una terapia combinada tiene un mejor impacto en mejorar o retrasar el deterioro de la visión en la AVMC, en comparación con la monoterapia, además de mejorar la regresión de la neovascularización sin aumento potencial de la incidencia de eventos adversos.8
“Mi mensaje para los especialistas que administran inyecciones anti-VEGF es que es fundamental continuar realizando PCPR en los ojos con PDR”, dice el Dr. Hsu. “Me doy cuenta de que nuestras prácticas ahora se basan en inyecciones, y arrojan una llave en el flujo del paciente al arrojar el láser. La PCPR lleva más tiempo; sin embargo, no deberíamos sacrificar el láser porque es inconveniente”.
Antes de comenzar cualquier tratamiento, los especialistas en retina tienen que preguntarse: ¿Qué tan probable es que este paciente continúe con el tratamiento?
“El riesgo de pérdida de seguimiento es enorme”, dice Jennifer I. Lim, MD, Marion H. Schenk Esq., cátedra de oftalmología para la investigación en el ojo envejecido, profesora distinguida de oftalmología de la Universidad de Illinois, en Chicago, vicepresidenta de diversidad e inclusión, y directora del servicio de retina en UIC. “Si a un paciente se le administra anti-VEGF y no se realiza un seguimiento, la desventaja es mucho peor que si se le administrara PCPR. Si tiene una inyección anti-VEGF y no vuelve a aparecer, no tengo idea: ¿funcionó?, ¿regresó en un mes, tres meses? Y entonces esos pacientes no son el tipo que me gustaría ponerles una anti-VEGF”.
Ella dice que algunos factores de riesgo de perder a pacientes durante el seguimiento incluyen el hecho de ser más joven en edad, trabajar en sitios que no permiten tomarse un tiempo libre para las citas, si tienen que viajar largas distancias para recibir atención, así como su estado socioeconómico y raza.
El Dr. Hsu estudió este tema7 e identificó tres factores de riesgo clave de la pérdida de seguimiento (loss to follow-up, LTFU): tipo de procedimiento, edad y raza. “LTFU es un problema más grande de lo que pensábamos”, dice. “Nuestro investigador, Anthony Obeid y yo publicamos por primera vez un artículo sobre el asunto en 2018. Estábamos mirando nuestra propia práctica y nos centramos en pacientes de alto riesgo con PDR que se habían puesto inyecciones o la PCPR. La pregunta que nos hicimos fue: cuando a un paciente se le pone una inyección anti-VEGF o PCPR, ¿cuántos de ellos no regresan por al menos un año o más inmediatamente después de ese tratamiento? Descubrimos que alrededor de una cuarta parte de estos pacientes en nuestra práctica se perdieron durante el seguimiento y es posible que no regresen durante un año o más, si es que lo harán alguna vez.
“Es realmente revelador y aterrador”, añade el Dr. Hsu. “En nuestro estudio, algunos de los factores de riesgo de pérdida del seguimiento parecían ser la edad más joven y ser afroamericano o hispano. También realizamos un análisis del código postal de donde viven los pacientes y observamos el ingreso bruto ajustado promedio en ese código postal para tener una idea del nivel de ingresos. Los pacientes que vivían en áreas con ingresos más bajos tenían un mayor riesgo de pérdida del seguimiento”.
Esto provocó otro estudio que evaluó los resultados de los ojos considerados LTFU durante más de seis meses después del procedimiento. La AV empeoró significativamente en ambos grupos, 20/187 para anti-VEGF y 20/83 para PCPR; sin embargo, el grupo PCPR volvió a la línea de base después de la terapia adicional. Ya el grupo anti-VEGF no logró tanta mejora en 20/166.9 Los autores también descubrieron que el 17% de los ojos en el grupo anti-VEGF desarrollaron un desprendimiento de retina traccional (DRT) en la cita de regreso, lo que aumentó al 30% en la visita final. En el grupo PCPR, ningún ojo tenía DRT en la cita de regreso y solo el 2% tenía DRT en la cita final.9
Por esta razón, algunos incluso pueden considerar la PCPR en primer lugar. “Con anti-VEGF, nunca me siento cómodo diciéndome: ‘Está bien, puedo volver a verle en un año’ ”, dice el Dr. Lim. “He tenido a pacientes que estaban muy motivados a regresar para su tratamiento, pero a veces lo interrumpían. Por eso últimamente he estado pensando que sería más fácil para el paciente – y para mí, de alguna manera – simplemente hacerle la PCPR; creo que es una solución más permanente. Y así nos preocupamos menos por la pérdida del seguimiento porque hay algunas cosas fuera del control del paciente”.
El Dr. Hsu dice que no hay una fórmula para predecir quién se perderá en el seguimiento. “Muchos pueden pensar que pueden predecir quién hará el seguimiento observando ciertas características del paciente”, dice. “Desafortunadamente, no sabemos cuándo alguien puede perder su trabajo, tener una enfermedad u otro problema que le impedirá regresar. Aun así, tenemos que fomentar el seguimiento y monitorear a estos pacientes. Realmente vale la pena tener a alguien en su personal que monitoree a cada paciente que recibe una inyección o láser. Si no van a volver, moléstenlos como locos con llamadas telefónicas, cartas certificadas, lo que sea necesario. Estamos enviando un estudio que pronto mostrará nuestros resultados después de contratar a una persona a tiempo completo cuyo trabajo principal es hacer precisamente eso. Si bien descubrimos que marcaba la diferencia, todavía no era el 100%”.
Construyendo la confianza del paciente
El tratamiento de la PDR será más exitoso cuando la relación médico-paciente es fuerte, dicen estos médicos.
“Cada vez que me acerco al tratamiento para la PDR, siento al paciente y le explico con mucho cuidado cuáles son las consecuencias si se presenta”, dice la Dra. Lim. “Desarrollo una relación similar a un trabajo en equipo. Su trabajo es aparecer e informarse sobre los síntomas, y mi trabajo es asegurarme de tratarlo adecuadamente. También recomiendo su aceptación sobre el tratamiento que hacemos, por lo que es una decisión compartida. Entonces, los pacientes sienten que han tenido algo que decir y que no se les ha impuesto nada”.
Gestionar la PDR para los pacientes también puede terminar convirtiendo la salud de un paciente en un sentido positivo, sugiere el Dr. Han. “Con la retinopatía diabética, los pacientes ya han visto a muchos proveedores de atención médica en sus vidas y han escuchado muchas malas noticias. A veces, lo que les despierta es la gravedad de su afección ocular, y se necesita mucho para generar confianza. El tratamiento se basa en confianza. Esta es una enfermedad sistémica, no sólo ocular. Pero usted puede salvar una vida y cambiarle la vida al paciente. Los ojos a menudo son los más valorados y pueden ser la motivación para recuperar el equilibrio de su vida”.
El Dr. Han informa que no hay divulgaciones. El Dr. Hsu es consultor de IvericBio, Gyroscope Therapeutics y Bausch + Lomb, y recibe apoyo de Genentech/Roche, IvericBio y Aldeyra Therapeutics. La Dra. Lim es consultora de Alcon, Aldeyra Therapeutics, Allergan, Chengdu Kanghong, Eyenuk, Genentech, IvericBio, Novartis, Regeneron y Santen.
- Fathy C, Patel S, Sternberg P Jr, Kohanim S. Disparities in adherence to screening guidelines for diabetic retinopathy in the United States: A comprehensive review and guide for future directions. Semin Ophthalmol 2016;31:4:364-77.
- Preliminary report on effects of photocoagulation therapy. The Diabetic Retinopathy Study Research Group. Am J Ophthalmol 1976;81:4:383-96.
- Preti RC, Ramirez LM, Monteiro ML, Carra MK, Pelayes DE, Takahashi WY. Contrast sensitivity evaluation in high risk proliferative diabetic retinopathy treated with panretinal photocoagulation associated or not with intravitreal bevacizumab injections: A randomised clinical trial. Br J Ophthalmol 2013;97:7:885-9.
- Photocoagulation treatment of proliferative diabetic retinopathy: The second report of diabetic retinopathy study findings. Ophthalmology 1978;85:1:82-106.
- Sivaprasad S, Prevost AT, Vasconcelos JC, Riddell A, Murphy C, Kelly J, Bainbridge J, Tudor-Edwards R, Hopkins D, Hykin P; CLARITY Study Group. Clinical efficacy of intravitreal aflibercept versus panretinal photocoagulation for best corrected visual acuity in patients with proliferative diabetic retinopathy at 52 weeks (CLARITY): A multicentre, single-blinded, randomised, controlled, phase 2b, non-inferiority trial. Lancet 2017;3:389:10085:2193-2203.
- Writing Committee for the Diabetic Retinopathy Clinical Research Network, Gross JG, Glassman AR, Jampol LM, Inusah S, Aiello LP, Antoszyk AN, Baker CW, Berger BB, Bressler NM, Browning D, Elman MJ, Ferris FL 3rd, Friedman SM, Marcus DM, Melia M, Stockdale CR, Sun JK, Beck RW. Panretinal photocoagulation vs intravitreous ranibizumab for proliferative diabetic retinopathy: A randomized clinical trial. JAMA 2015;314:20:2137-2146.
- Obeid A, Gao X, Ali FS, Talcott KE, Aderman CM, Hyman L, Ho AC, Hsu J. Loss to follow-up in patients with proliferative diabetic retinopathy after panretinal photocoagulation or intravitreal anti-VEGF injections. Ophthalmology 2018;125:1386-1392.
- Zhang W, Geng J, Sang A. Effectiveness of panretinal photocoagulation plus intravitreal anti-vegf treatment against prp alone for diabetic retinopathy: A systematic review with meta-analysis. Front Endocrinol (Lausanne) 2022;29:13:807687.
- Obeid A, Su D, Patel SN, Uhr JH, Borkar D, Gao X, Fineman MS, Regillo CD, Maguire JI, Garg SJ, Hsu J. Outcomes of eyes lost to follow-up with proliferative diabetic retinopathy that received panretinal photocoagulation versus intravitreal anti-vascular endothelial growth factor. Ophthalmology 2019;126:3:407-413.