 Por la Dra. Silvia Moguel-Ancheita, oftalmólogo, estrabólogo, máster en neurociencias
Por la Dra. Silvia Moguel-Ancheita, oftalmólogo, estrabólogo, máster en neurociencias
Mira Centro Oftalmológico.
Caso clínico
Paciente femenina de 9 meses de edad en consulta de oftalmología por movimientos oculares anormales. Nació por cesárea el 30 de septiembre de 2020, madre de 12 años con desnutrición, gesta. 1. Antecedente de defecto de crecimiento intrauterino y datos de sufrimiento fetal, con 26 semanas de gestación, peso 520 g. Requirió unidad de terapia intensiva por 75 días, en intubación y oxígeno a presión desconocida, con displasia broncopulmonar, cursó con sepsis, neumonía, insuficiencia renal, apneas y paro cardiorrespiratorio en dos ocasiones, se reportaron convulsiones aisladas, hemorragia ventricular grado III, sin datos de hidrocefalia. Es traída por la abuela materna quien notó movimientos oculares anormales, por lo que solicitaron la revisión oftalmológica; tiene diagnóstico de leucomalacia periventricular, y parálisis cerebral espástica. No recibió revisión oftalmológica durante su internamiento.
A la exploración se encuentra defecto grave de atención, dificultad para la fijación, nistagmo de baja intensidad, pero gran amplitud con movimientos en orejas de conejo, al frente movimiento pendular horizontal con fases de flutter y presencia de desviaciones de la mirada tónicas hacia abajo; segmento anterior sano, cristalino transparente en ambos ojos, fondo de ojo con retinopatía del prematuro (ROP) grado III en ambos ojos, palidez + de II par craneal. Defecto refractivo: bajo cicloplejia: +6.50 esf ambos ojos.
La abuela refiere la dificultad de tener atención oftalmológica en su lugar de origen, área socioeconómica baja; el pediatra le había comentado que los movimientos eran normales en prematuros; recibió video conferencia con oftalmólogo quien indicó que podía esperar a que madure, y que en ese momento no se podía realizar revisión armada por la pandemia.
Diagnóstico actual: Discapacidad visucerebral, nistagmo de gran amplitud, retinopatía del prematuro, hipermetropía alta.
Se inició tratamiento medicamentoso, rehabilitación visual y uso de refracción a permanencia, queda programado para aplicación de botulínica. Se envía a rehabilitación a medicina física y control neuropediátrico.
Discusión
La Organización Mundial de la Salud ha considerado que hay 15 millones de nacimientos prematuros cada año, con una proporción diversa del 5% al 18% de los recién nacidos vivos, afectando más a África y Asia meridional; relacionado con pobreza, menor acceso a los servicios de salud y una mayor tasa de discapacidad. Más del 70% de los problemas de discapacidad están relacionados con el nacimiento, afectando a la persona, desde la escolaridad hasta el empleo en la edad adulta. Las cifras de bebés prematuros incrementa el número de personas con discapacidad. La pandemia COVID-19 ha aumentado las cifras de embarazo infantil y adolescente en un 20% y del nacimiento de prematuros en 30% (hospital de la Mujer, México). La conversión hospitalaria, el cierre de servicios de salud, las dificultades y pobre normatividad de las posibles atenciones médicas a distancia en videoconferencia sin la posibilidad de una revisión completa, entre otros defectos, han impedido que los niños con nacimiento prematuro reciban la revisión, vigilancia y tratamiento de la retinopatía del prematuro (ROP) y de los estrabismos y nistagmos de manera adecuada, lo que seguramente veremos reflejado en las cifras de discapacitados visuales en los siguientes años, que es sabido que afectan especialmente zonas suburbanas, marginadas, áreas de pobreza, rurales, personas discapacitadas, mujeres, ancianos y niños, pero que agravado por el estado de pandemia, el encierro y la falta de acceso a los servicios de salud, ahora han incluido a personas con enfermedades crónicas que previamente habían estado controladas. Estos problemas no-covid pero en la época pandémica la hemos llamado: drama silencioso. (1-3)
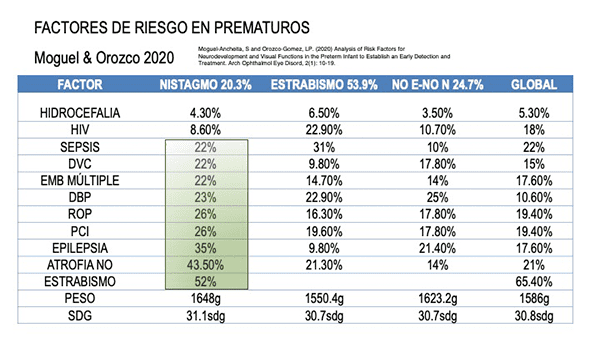
Los factores de riesgo al nacer prematuros
Los defectos de la Discapacidad visucereral (DVC) en el procesamiento, comprensión y aprendizaje visuespaciales afectan el desarrollo del niño tanto en las habilidades motoras como mentales y es una limitante para la independencia y calidad de vida. La dificultad para identificar todas las manifestaciones que pueden sumarse a la DVC puede retrasar la posibilidad de una rehabilitación temprana. La frecuencia con la que puede aparecer en el niño prematuro es una de las razones para anticipar su detección de modo intencionado.
Una de las causas más importantes de DVC es la encefalopatía hipóxico-isquémica perinatal, en sustancia gris, hipocampo, tálamo y tronco encefálico; así como las lesiones de leucomalacia periventricular que se presentan en el prematuro asociadas a hemorragia ventricular. En ambas situaciones, habrá daño a áreas sensoriales, motoras y cognitivas. (4)
La presencia de convulsiones en los niños que han sufrido una hemorragia ventricular (HV) se ha asociado con bajo peso y pocas semanas de embarazo y sepsis; aunado a la leucomalacia, puede afectar la comunicación axonal adecuada y ser un factor en el desarrollo de parálisis cerebral infantil (PCI).
Los niños menores de 28 sdg tienen aproximadamente tres veces más probabilidades de sufrir HV grave. Ocurre con más frecuencia entre las 24-48 horas después del nacimiento y es más común en madres muy jóvenes, peso bajo del niño <1500 g, o una edad gestacional baja, ocurriendo hasta en un 90% en menores de 32 semanas.
La leucomalacia periventricular es una complicación que se produce por necrosis de la sustancia blanca periventricular, dorsal y lateral a los ángulos externos de los ventrículos laterales. Dependiendo del grado de lesión, se puede asociar a PCI, lesiones sensoriales y neurales, visuales, auditivas, somestésicas y cognitivas. (5,6)
La sepsis aumenta significativamente la morbilidad de los prematuros y es inversamente proporcional a la edad gestacional, relacionada al bajo peso y a los efectos de la hipotensión y disminución del flujo cerebral, con efectos importantes sobre la sustancia blanca y por tanto con daño cognitivo, motor, y en funciones de memoria y atención. (7)
El factor más importante para la presencia de HV y DVC es la Displasia broncopulmonar (DB), asociados a fenómenos hipóxicos, y relacionada a mayor frecuencia de ROP; especialmente en niños de bajo peso y muy prematuros. Ante la DB, la oxigenoterapia requiere en ocasiones una mayor agresividad y, en consecuencia se observará mayor ROP, por lo que ROP puede resultar en un marcador de daño neurológico y sensorial. (8)
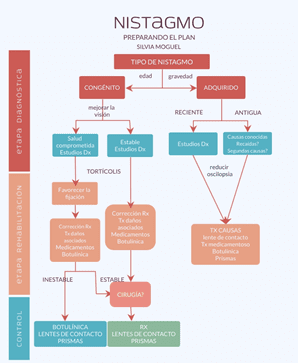
El nistagmo se ha asociado a DB, hipoxia, apneas y atrofia del nervio óptico. Es una patología que afecta gravemente el desarrollo visual adecuado y empeora a su vez las características propias de la DVC, los funciones de atención, comprensión y supervivencia, así como las de visión, tanto por las condiciones que lo generan como por las características que le acompañen, como el tipo de movimiento e intensidad, y todo ello aunado al empeoramiento por retraso en el diagnóstico y tratamiento. (Ver figura 1)
El momento en que la visión debe ser estimulada para su desarrollo hacia los dos primeros meses de vida coincide con el establecimiento de los movimientos anormales en el nistagmo, asociado a una mala integración y maduración de los subsistemas, especialmente el de seguimiento, y la falta de tiempos y espacios correctos para la foveación corresponderá con grados de discapacidad visual; este tipo de ambliopía de difícil manejo debe abordarse lo más temprano posible.
La ambliopía es uno de los factores más urgentes en la rehabilitación del prematuro. La posibilidad de que las lesiones binoculares por daño en la recepción retinotópica en la Corteza Visual Primaria puedan lograr una reorganización a través de la recuperación axonal con una remodelación en la interconectividad e incluso la recuperación de la conectividad originalmente dañada, sugiere que la plasticidad depende de la experiencia, atención y actividad que pueden ser estimuladas para favorecer y consolidar los cambios dinámicos necesarios para las funciones perceptivas visuales. (9-11)
Múltiples estudios han demostrado la participación para funciones perceptuales de la Corteza Visual Primaria, corteza medial, áreas intraparietal lateral, frontoparietal, temporomedial, entre otras y que están sujetas al tipo de estimulación que reciben, orientación, velocidad, dirección del movimiento, contraste, etc, proveniente en gran medida de los órganos receptores de la imagen. La calidad de esta actividad neurosensorial deberá estimular los circuitos cerebrales, tanto para la discriminación como para la detección y comprensión y establecer una respuesta correspondiente favoreciendo las funciones de atención y respuesta hacia una capacidad cada vez más fina y de mejor calidad en los siguientes meses de vida. Los mecanismos de atención permitirán categorizar la información más relevante, resultando fundamentales también para poder implementar el manejo a través de aprendizaje perceptual. Estos mecanismos de atención logran su maduración mediante una conectividad más efectiva entre grupos neuronales que transportan información relevante con patrones de sincronización selectiva, que a su vez son capaces de modular patrones de interacción hacia otros grupos neuronales para mejorar respuestas visuomotoras progresivamente más complejas, respondiendo al comportamiento neuronal propuesto por Hebb. (12)
Esta atención selectiva va adquiriendo la capacidad de activarse incluso fracciones de segundos previos a la llegada del estímulo, mecanismo indispensable para la respuestas de defensa y supervivencia primitiva y que debe continuar bajo una sincronización más compleja y fina durante el desarrollo de la persona, cada vez con una mejor calidad y especificidad. (13)
Las estructuras cerebrales activadas durante los mecanismos de atención que operan para la percepción espacial son relevantes también para los conceptos de identidad, ubiquidad y patrón social; por ejemplo, la unión temporoparietal que incluye la referencia y cognición social en la que la persona puede discernir el estado mental de los demás o sentir empatía, parten de los circuitos de desarrollo y supervivencia correspondiente a un niño de tan temprana edad como 6 a 8 meses. Por todo ello es que el diagnóstico temprano y el tratamiento eficaz de las alteraciones oculomotoras resultan prioritarios. (14,15)
Conclusiones
Los efectos neurovisuales que ocurren en el bebé prematuro pueden ser múltiples, diversos y peligrosos. Los conceptos actuales de DVC incluyen alteraciones en la percepción, comprensión y capacidad de respuesta del niño. Riesgos como HV, DB, hidrocefalia, epilepsia, leucomalacia, estrabismo, nistagmo, ROP, pueden ser factores que pueden incrementar los índices de PCI, dificultades de aprendizaje, atención, comprensión, supervivencia y visión, que repercutirán seriamente en el desarrollo en todas las fases del humano, impactando en los diferentes tipos de inteligencia incluida la emocional, en las habilidades visumotoras, así como en las funciones superiores, desde el pensamiento abstracto hasta la toma de juicios.
La detección temprana de los factores de riesgo y de tipo de discapacidad visual pueden ayudar a establecer un tratamiento de manera más eficaz al instalarlo oportunamente. Un manejo adecuado de los estrabismos, nistagmos y de la ambliopía, considerando los efectos sobre la interconectividad cerebral múltiple, mejoraría las condiciones de las funciones de atención, memoria, habilidades psicosociales y visuomotoras, impactando globalmente en una mejor calidad de vida. (Ver figura 2-3)
Hablemos de esto y más en el Curso de Discapacidad Visual en Pandemia,” Viendo con ojos nuevos”, el día 3 de septiembre 2021.

REFERENCIAS
1) WHO: PRETERM BIRTH. https://www.who.int/es/news-room/fact-sheets/detail/preterm-birth (19 Jun 2020)
2) Moguel-Ancheita S. Cuestionario sobre el impacto de la pandemia en la atención del estrabismo y la ambliopía en Latinoamérica. Rev Mex Oftalmol. 2021;95(3)
http://www.scielo.org.mx/pdf/rmof/v95n3/2604-1731-rmo-95-3-107.pdf
3) SEDESOL. Diagnóstico sobre la situación de las personas con discapacidad en México. 2016. Secretaría de Desarrollo Social. (Accesed 19 jun 2020)
https://www.gob.mx/publicaciones/articulos/diagnostico-sobre-la-situacion-de-las-personas-con-discapacidad-en-mexico?idiom=es
4) Martín MB, Santos-Lozano A, Martín-Hernández J, López-Miguel A. Cerebral versus Ocular Visual Impairment: The Impact on Developmental Neuroplasticity. Frontiers Psychol. 2016. 1-9
://doi.org/10.3389/fpsyg.2016.01958
5) Adams-Chapman I, Heyne RJ, DeMauro SB, Duncan AF, Hintz SR, Pappas A, Vohr BR, et al. Neurodevelopmental Impairment Among Extremely Preterm Infants in the Neonatal Research Network. Pediatrics. 2018 May; 141(5): e20173091.
DOI: 10.1542/peds.2017-3091
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5914487/#__ffn_sectitle
6) Roman-Lantzy Ch. Cortical Visual Impairment. Provincial Resource Centre for Visually Impaired. 2010. March 4- 5; 6-19.
7) Cai S, Thompson DK, Anderson PJ, Yang JY. Short- and Long-Term Neurodevelopmental Outcomes of Very Preterm Infants with Neonatal Sepsis: A Systematic Review and Meta-Analysis. Children (Basel). 2019 Dec; 6(12): 131.
DOI: 10.3390/children6120131
8) Podraza W, Michalczuk B, Jezierska K, Domek H, Kordek A, Łoniewska B, Modrzejewska M, Kot J. Correlation of Retinopathy of Prematurity with Bronchopulmonary Dysplasia. Open Med (Wars). 2018; 13: 67–73
https://dx.doi.org/10.1515%2Fmed-2018-0012
9) Sidorov MS, Kaplan ES, Osterweil EK, Lindemann L, Bear MF. Metabotropic glutamate receptor signaling is required for NMDA receptor-dependent ocular dominance plasticity and LTD in the visual cortex. Proc Natl Acad Sci U S A. 2015 Oct 13; 112(41): 12852–12857.
DOI: 10.1073/pnas.1512878112
10) Coleman JE, Heynen AJ, Bear MF. The molecular and structural basis of amblyopia. In: Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 100: 1433-1444.
11) Li W, Gilbert CH. Perceptual learning and plasticity in Primary Visual Cortex. En Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 70: 1001-1011.
12) Sasaki Y, Watanabe T. Perceptual learning. In: Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 69: 991-999.
13) Womelsdorf T, Bosman C, Fries P. Selective neuronal synchronization and Attentional stimulus selection in Visual Cortex. In: Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 71:1013-1030.
14) Boynton G, Kastner S. Neuroimaging Studies on Human Attention Networks in Visual and Frontoparietal Cortex. En Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 75:1092-1093.
15) Moguel-Ancheita S, Orozco-Gomez LP. Analysis of Risk Factors for Neurodevelopment and Visual Functions in the Preterm Infant to Establish an Early Detection and Treatment. Arch Ophthalmol Eye Disord, 2020 2(1): 10-19. C












