Por Christine Yue Leonard, editora sénior asociada
Los expertos comparten cómo controlar el glaucoma y discuten la próxima generación de pruebas remotas.
Sin una definición unificada de glaucoma y lo que significa que empeore, el seguimiento de la progresión de la enfermedad es una forma de arte. Aquí, los expertos desglosan los elementos clave del seguimiento del glaucoma con tomografía de coherencia óptica y campos visuales, y discuten el potencial de la realidad virtual y los dispositivos de seguimiento remotos.
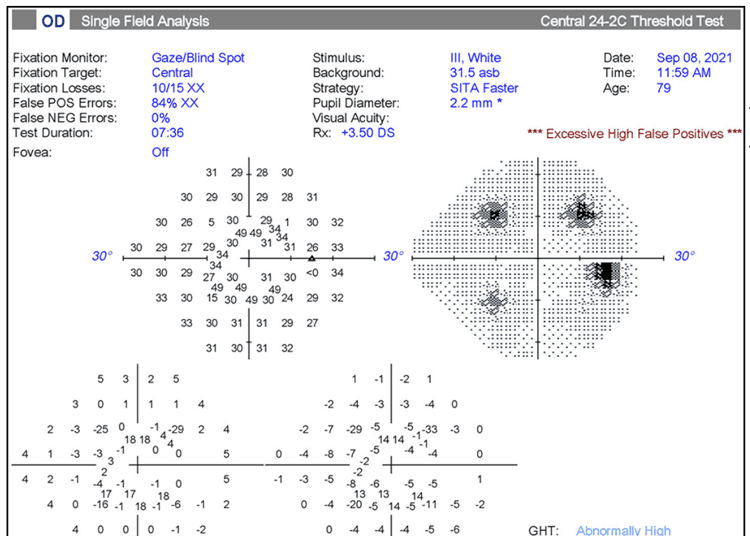
Figura 1. Ejemplo de artefacto de prueba de campo visual. El paciente no respondió a los estímulos iniciales en los cuatro cuadrantes de prueba preliminares. Después de la instrucción de responder a los estímulos, el paciente posteriormente “respondió en exceso” durante el resto de la prueba, como lo demuestra la alta tasa de falsos positivos. Foto: Ahmad Aref, MD, MBA.
Evaluación de la estructura y la función
Al examinar a los pacientes en busca de signos de progresión, los expertos observan varios parámetros de OCT, incluido el nervio óptico, el espesor de la capa de fibra nerviosa retiniana peripapilar, los espesores de cuadrante superior e inferior y el espesor del complejo de células ganglionares. Los cambios observados en la OCT se comparan con los hallazgos de la biomicroscopía de lámpara de hendidura directa o los campos visuales, y viceversa.
Se utilizan tres pruebas estructurales principales: el escaneo circular, el escaneo sectorial y el escaneo macular. “Cada una de estas pruebas tiene beneficios para determinados pacientes, por lo que las usamos todas”, dice Steven L. Mansberger, MD, MPH, presidente de oftalmología de Chenoweth y director del servicio de glaucoma en el Devers Eye Institute, en Portland. “La medición del espesor global de la RNFL en el escaneo circular es una combinación de todos los cuadrantes. Lo que constituye un cambio significativo es discutible, pero un cambio de 10 µm generalmente se considera significativo. Sin embargo, si ve un cambio de 6 µm en un paciente que obviamente está progresando, no hay necesidad de esperar hasta que muestre 10 µm de cambio para tomar una decisión.
“En la investigación, también utilizamos el ancho mínimo del borde, que es un escaneo sectorial del nervio óptico”, continúa. “Todavía estamos tratando de entender dónde encaja mejor este parámetro en nuestra evaluación de pacientes con glaucoma. Puede ser más útil que el escaneo circular para monitorear a los pacientes que han llegado al piso. El espesor macular es otro parámetro que estamos estudiando. Estamos tratando de entender cómo encaja en el análisis estructural porque se ve afectado por enfermedades de la retina de la mácula. En general, estas pruebas estructurales funcionan mejor en el glaucoma temprano porque muchos pacientes llegan al piso en etapas posteriores de la enfermedad.
Yvonne Ou, MD, profesora de oftalmología en la Facultad de Medicina de la Universidad de California, San Francisco, dice que cuando los pacientes llegan al piso, lo que demuestra un espesor promedio de RNFL inferior a 70 µm (en Optovue RTVue), la OCT ya no puede ser útil. “El efecto piso hace que sea muy difícil seguir a los pacientes estructuralmente”, dice. “Los campos visuales son más útiles para las etapas posteriores del glaucoma. Tenga en cuenta; sin embargo, que a veces los pacientes pueden tener un espesor medio de RNFL inferior a 70 µm, pero habrá un sector o varios que no están en el piso. Estos sectores podrían incluso ser potencialmente normales en comparación con la base de datos normativa. Es posible que usted aún pueda seguir a estos pacientes con OCT solo en esos sectores específicos.
“Por lo general, anualmente obtengo campos visuales para pacientes con glaucoma temprano y leve, y sin cambios en el campo visual, y a veces, cada dos años para un sospechoso de glaucoma del que tengo poca sospecha”, continúa. “El glaucoma de temprano a moderado, a menudo requiere pruebas de campo visual cada seis meses. Para los pacientes con glaucoma de moderado a avanzado, la OCT puede estar en el piso; así que confío más en las pruebas de campo visual, y las hago tres o cuatro veces al año”.
“Cuando los campos visuales se vuelven bastante severos, con una desviación media por debajo de -19 dB, es más útil cambiar a un estímulo de tamaño cinco porque esto aumenta la frecuencia de ver a un nivel en el que el paciente podría detectar esa área, en comparación con un estímulo de tamaño tres”, señala el Dr. Mansberger. “También recomendamos cambiar a un campo visual 10-2 cuando el campo visual de un paciente amenaza su fijación, porque el 10-2 tiene muchas más presentaciones centrales.
“Asegúrese de observar la desviación media en unas pocas citas, al medir la progresión en los campos visuales”, añade. “El límite para tener una pérdida relativamente rápida, que creemos que afecta la calidad de vida, es de 1 dB de cambio por año, con un cambio correspondiente del 2,5% por año, en el índice del campo visual”.
Michael V. Boland, MD, PhD, profesor asociado de oftalmología en la Facultad de Medicina de Harvard y director del sitio del Massachusetts Eye and Ear, Lexington, señala que uno de los desafíos logísticos del seguimiento del glaucoma es que, a menudo, no es posible realizar pruebas de campo visual más frecuentes. “Necesitamos hacer más pruebas para identificar rápidamente a las personas que están empeorando”, dice. “Se necesitan varias pruebas por año; una o dos no siempre es suficiente, especialmente teniendo en cuenta la variabilidad en la prueba. Nos vemos obstaculizados por problemas de personal, tiempo y espacio en la clínica. Una cosa que mi práctica está haciendo para recopilar más datos de pacientes es hacer que ciertos pacientes vengan con más frecuencia solo para las pruebas de campo visual”.
Los estudios han informado que la pérdida de densidad de vasos, medida en OCT-A, puede ser un parámetro predictivo para detectar la progresión en el glaucoma avanzado; sin embargo, en su mayor parte, los pacientes que usan la OCT-A permanecen en el ámbito de la investigación. “Todavía estamos esperando a que la OCT-A demuestre un valor predictivo más allá de lo que estamos obteniendo con solo mediciones estructurales”, dice el Dr. Boland. “Es un concepto interesante, pero no tenemos evidencia clara de que cualquier cambio en el flujo sanguíneo sea predictivo, si ocurre antes o incluso simultáneamente con la pérdida de tejido nervioso real que ya hemos medido”.
Variabilidad Test-retest
Las pruebas más frecuentes ayudarán a mitigar alguna variabilidad de test-retest, que es otro desafío que enfrenta cada especialista en glaucoma. “Si un paciente tomara la misma prueba exacta dos veces durante una sola cita, habría alguna variación entre las dos debido a un error dentro del propio instrumento o artefactos, como el operador de la prueba y la capacidad de atención o el estado de alerta del paciente”, dice Ahmad A. Aref, MD, MBA, profesor asociado de oftalmología, director médico y vicepresidente de Asuntos Clínicos en el departamento de oftalmología y ciencias visuales de la Facultad de Medicina de la Universidad de Illinois. “Cuanto más frecuentemente hacemos pruebas, más seguros podemos estar de que un defecto determinado puede empeorar”.
Muchos instrumentos de OCT y de campo visual tienen un software del fabricante que tiene en cuenta la variabilidad del test-retest al analizar el cambio. Si la variabilidad del test-retest de un instrumento es de 7 µm, por ejemplo, cualquier cambio en la medición del espesor mayor de 7 µm se consideraría significativo. Los niveles de error de los instrumentos también pueden variar en función del parámetro. Por ejemplo, el Cirrus OCT tiene una variabilidad de 4 a 5 µm del espesor medio de la RNFL, pero una variabilidad de 7 a 8 µm para los cuadrantes de la RNFL.1
Confíe en el software
Al evaluar la progresión de la enfermedad, los expertos dicen que el software de progresión proporcionado por el proveedor es su amigo. Sin embargo, sigue siendo importante revisar los escaneos originales en busca de cosas que pueden haber pasado por alto o cualquier artefacto.
El software Heidelberg Spectralis Glaucoma Module Premium Edition basa su análisis principalmente en los valores del círculo de cálculo RNFL y BMO-MRW. Maestro2 OCT, de Topcon, utiliza el Hood Report, que muestra la RNFL circumpapilar desplazada y un mapa de umbral simulado.
El Dr. Aref explica que el análisis de progresión guiada (Guided Progression Analysis), de Zeiss, compara una prueba actual, ya sea OCT o campo visual, con la(s) prueba(s) más reciente(s) o con la prueba inicial de un paciente. El GPA (su sigla en inglés) incorpora lo que se esperaría para cada lugar de prueba en términos de varianza normal; cualquier cosa fuera de esto desencadena una alerta de posible empeoramiento de la enfermedad. El software de progresión de Zeiss requiere al menos tres pruebas para determinar la progresión “posible” y al menos cuatro pruebas para determinar la progresión “probable”.
“Si un determinado parámetro ha empeorado más allá de lo que uno esperaría de la variabilidad de test-retest, y si ese empeoramiento ocurriera durante dos pruebas consecutivas, diría que eso es progresión, excluyendo cualquier otra posible razón no glaucomatosa para empeorar”, dice.
“Confío en gran medida en el software ofrecido por el proveedor y en el Guided Progression Analysis para los campos visuales”, dice el Dr. Boland. También utilizo un informe combinado como respaldo, un análisis de estructura-función proporcionado para el Cirrus y el analizador de campo Humphrey (Humphrey Field Analyzer), que ofrece un análisis de cambio tanto para el campo visual como para el nervio óptico, juntos en la misma pantalla. Esto es útil para tratar de correlacionar los cambios en el campo visual con los cambios en el nervio óptico. Las herramientas de Zeiss también nos permiten interactuar con las pruebas, eliminando las que no nos gustan, para que podamos reiniciar el análisis.
La Dra. Ou dice que el software de análisis de tendencias de RTVue rastrea el espesor de la RNFL y GCC; traza seis pruebas en una sola impresión: dos pruebas de referencia y cuatro de seguimiento. “Como usuario, puede seleccionar cuáles son las pruebas de referencia”, dice. Para los pacientes que han sido seguidos durante una década o más, su prueba de referencia puede no ser relevante. Digamos que habían demostrado progresión y, luego, hicimos la cirugía de glaucoma. Reajustaría su línea de base seleccionando dos pruebas que siguieron a la intervención. También se puede hacer con campos visuales. En el software Zeiss Forum, puede establecer las pruebas de referencia y anotar cuándo se produjeron las intervenciones.
Impedimentos de interpretación
Hay muchos artefactos que pueden complicar la interpretación precisa de la OCT y los campos visuales, desde errores de segmentación hasta una cooperación deficiente del paciente. “Si un estudio se ve afectado por un artefacto (Figura 1), no debe dudar en repetirlo”, dice el Dr. Aref. “Las pruebas se pueden repetir tantas veces como sea necesario para obtener un estudio bueno y preciso para el análisis de la progresión”.
Aquí hay algunos artefactos que pueden afectar la calidad de la exploración y los resultados de las pruebas:
- Opacidades de los medios, ojo seco y enfermedad corneal. Cualquiera de estos puede evitar que la luz se enfoque correctamente, lo que resulta en una exploración de OCT de mala calidad. Además, los pacientes con ojo seco pueden requerir colirios antes de tomarse la prueba de campo visual.
- Ptosis palpebral. Los párpados caídos, que se observan con mayor frecuencia en pacientes mayores, pueden dar la apariencia de un defecto visual, ya que el paciente no puede ver los estímulos oscuros.
- Cataratas. Las cataratas pueden afectar tanto la OCT como los campos visuales al obstruir la luz. “En el caso de los campos visuales, el paciente no está viendo los estímulos no debido al glaucoma, sino a las cataratas”, dice el Dr. Aref.
- Fatiga. El artefacto fatiga es común para las pruebas de campo visual. “Los campos visuales dependen de la respuesta activa del paciente”, señala el Dr. Aref. “Muchos de nuestros pacientes son mayores y la fatiga puede limitar su capacidad para responder a los estímulos, incluso si se ven estímulos”.
- Nervio óptico anormal. Un nervio óptico anormal no es necesariamente glaucoma; es simplemente diferente de la base de datos normativa. “Los nervios ópticos de los pacientes miopes a menudo tienen una forma ligeramente diferente, algo inclinada o alargada”, continúa. Debido a que la OCT compara la prueba con individuos no miopes (normativos), puede sugerir que esta anormalidad es glaucoma. La miopía no es un artefacto, sino un verdadero defecto. La clave es que cuando están relacionados con la miopía, casi siempre no progresan”.
- Adelgazamiento relacionado con la edad. “En un miope leve es posible que usted no espere que haya ningún cambio año tras año; así que, si observa algún adelgazamiento de la RNFL, considere que la edad es un factor de riesgo para el adelgazamiento”, dice la Dra. Ou. “Probablemente haya algún declive relacionado con la edad, especialmente en pacientes mayores”.
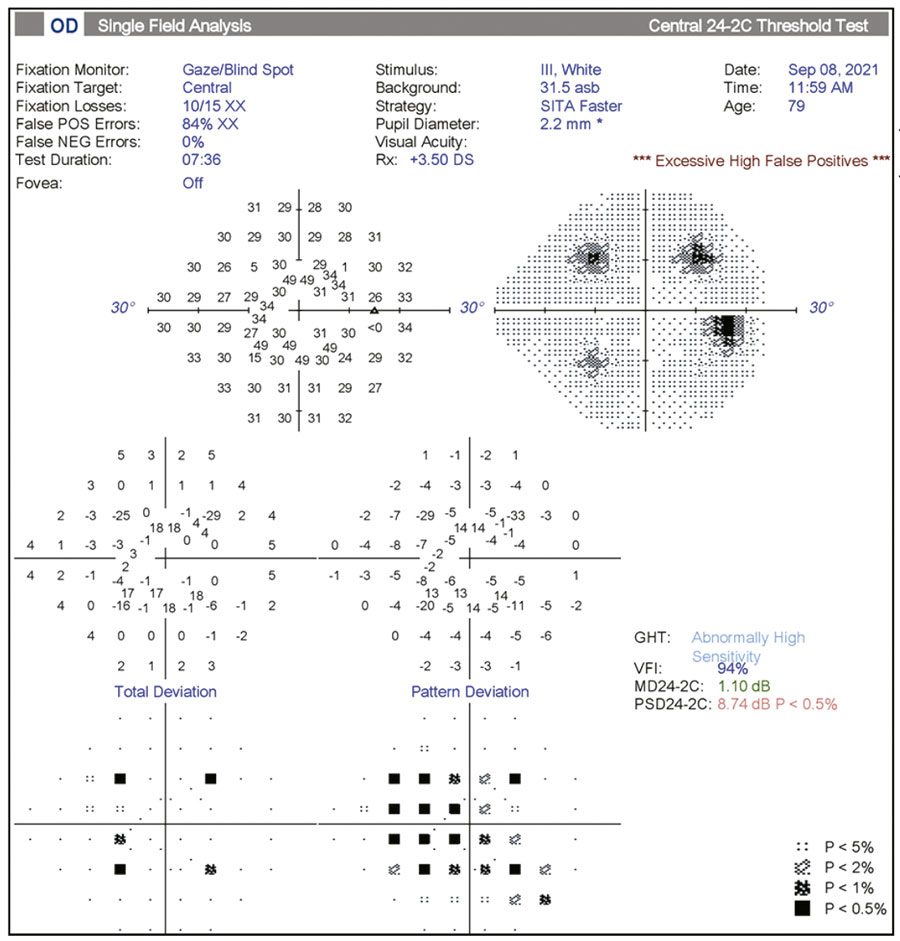
- Esquisis. “La esquisis, o separación de las capas de la retina, comúnmente se pasa por alto”, dice el Dr. Mansberger. “Puede ser sutil, y puede ir y venir (Figura 2). Algunos instrumentos no le permiten inspeccionar realmente el escaneo. A veces, tendrán algoritmos de suavizado que dificultan la detección de esquisis”.
- Atrofia peripapilar. “La atrofia peripapilar ocurre alrededor del nervio óptico; usted verá áreas donde el epitelio pigmentario de la retina se adelgaza o falta”, continúa. “Esto creará un artefacto. A veces, las personas pueden no darse cuenta de que el escáner está pasando por un área de atrofia peripapilar, y es por eso por lo que el escaneo se ve tan anormal.
- Errores de fijación. Los errores de fijación son bastante comunes y se producen cuando el dispositivo no centra la imagen en la misma ubicación a lo largo del tiempo. “Parecerá que el tejido se ha vuelto delgado en un área determinada, y eso se debe a que la imagen no se ha centrado adecuadamente”, dice el Dr. Mansberger.
Realidad virtual
La prueba de campo visual estándar es clave para diagnosticar y controlar el glaucoma, pero es subjetiva, tarda varios minutos en administrarse y requiere que los pacientes miren fijamente la máquina durante largos períodos. Los expertos dicen que la perimetría de realidad virtual puede mejorar algunos de estos problemas. Estos dispositivos ganaron atención adicional durante la pandemia, cuando la necesidad de herramientas portátiles de monitoreo remoto se hizo más evidente que nunca.
“Estoy muy entusiasmado con la realidad virtual para detectar la pérdida de campo visual”, dice el Dr. Mansberger. “Estos dispositivos son portátiles, no se necesita una habitación especial para usarlos y pueden emplear las mismas tecnologías que están disponibles en máquinas de campo visual más caras. Son ideales para pacientes que tienen problemas de movilidad o para posicionarse en una máquina normal”.
Sin embargo, todavía hay varios obstáculos con los que estos dispositivos deben lidiar antes de que puedan disfrutar de una adopción clínica generalizada. “Hasta ahora, la mayoría de estos dispositivos no tienen grandes datos normativos transversales, por lo que no sabemos qué es normal y qué es anormal”, señala el Dr. Boland. Entonces, si tienen esos datos, muchos aún no tienen datos normativos longitudinales sustanciales, por lo que no podemos decir si alguien está empeorando o no. Eso es clave desde una perspectiva clínica. El concepto de hacer que la prueba sea más fácil de realizarse, y en diferentes entornos, es muy prometedor, pero todavía hay mucho trabajo por hacer antes de que estén listos para la clínica”.
“Otra de las desventajas es que hay muchos algoritmos y diferentes dispositivos que se utilizan”, dice el Dr. Mansberger. “No se puede tomar los resultados de uno y realizar un seguimiento de la progresión, si el paciente cambia repentinamente a un dispositivo diferente. También puede ser un desafío integrar estos dispositivos en su EHR (Electronic Health Records)”.
Hay varios dispositivos de realidad virtual en desarrollo montados en la cabeza, como:
- VisuALL (Olleyes). El perímetro de VisuALL se ha estudiado en Wills Eye Hospital y en la Universidad de Alabama, Birmingham. Los investigadores informaron una confiabilidad test-retest de la desviación media global “excelente” y una adherencia del 100% entre el 76% de los pacientes (n=17) en un pequeño estudio sobre el cumplimiento y la repetibilidad del dispositivo en el hogar.2En comparación con el Humphrey Field Analyzer (n=102 ojos), el VisuALL tuvo una correlación significativa de la sensibilidad media global (p=0.001) y un alto rendimiento de diagnóstico en pacientes normales y con glaucoma.3
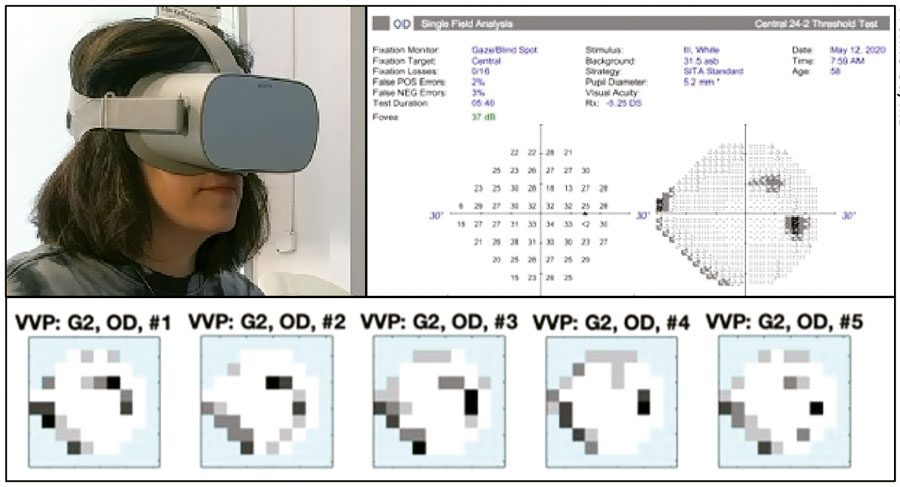
- Vivid Vision Perimeter (Vivid Vision). La Dra. Ou ha probado y validado el Vivid Vision Perimeter (Figura 3). “El poder de todos estos dispositivos de campo visual de realidad virtual está en su portabilidad y coste relativamente bajo”, dice. “Los pacientes pueden recopilar muchos más datos y podemos hacerle más pruebas para superar los problemas de variabilidad. Hemos enviado a los pacientes a casa con los cascos y los hemos entrenado a través de Zoom. Mientras realizábamos nuestro estudio, estábamos limitados de alguna manera por la pandemia, pero pudimos demostrar la viabilidad de la capacitación remota para las pruebas autoadministradas por el paciente.
“Hicimos que los pacientes se hicieran la prueba 10 veces durante un período de 14 días”, continúa. “Encontramos que la aceptabilidad del paciente de tomarse la prueba, así como la variabilidad del test-retest, eran bastante buenas. Esta prueba en particular es única entre algunas de las pruebas de campo visual de realidad virtual porque utiliza una estrategia de prueba diferente que no requiere que los pacientes supriman su reflejo de foveación, como es el caso con la perimetría automatizada estándar. En esta prueba, los pacientes observan el estímulo moviendo la cabeza hacia él. También pueden utilizar un puntero de control remoto. Este enfoque es más fácil e intuitivo para muchos pacientes porque no tienen que suprimir su deseo de mirar los estímulos.
“Tenemos pruebas que son a la vez contraste fijo y contraste mixto”, dice. “Tenemos varios centros que prueban este perímetro, incluida la Universidad de Nueva York. Necesitamos demostrar que el dispositivo puede detectar la estabilidad del paciente y la progresión del campo visual. Estos estudios tomarán tiempo, pero están en marcha”.
- VF3 (Virtual Field). Las pruebas de campo visual utilizando el perímetro VF3 Virtual Field (estrategia BOLT) fueron similares a las de HFA SITA-Standard 24-2, según un estudio retrospectivo realizado durante la pandemia, por el departamento de oftalmología de la Universidad de Stony Brook.4 Un total de 76 pacientes se sometieron a pruebas de campo visual virtual, a 48 de los cuales se les realizó HFA el último año. Los investigadores informaron que las pruebas virtuales no demostraron diferencias en la proporción de pérdidas de fijación (diferencia media -0,08, p=0,45) o el número de falsos negativos (diferencia media el 2,07%; p=0,05). Además, no encontraron diferencias significativas en la desviación media entre ambos dispositivos (diferencia media 4.11; p=0.45). En comparación con HFA, VF3 tuvo una desviación de patrón e índice de campo visual más bajos (diferencias medias -0,23 y -2,87, respectivamente; ambos p=0,05). Las pruebas de realidad virtual tardaron una media de 2,4 minutos menos que la del HFA.
- VirtualEye (BioFormatix). VirtualEye realiza el equivalente a un campo visual de 24-2 de umbral completo. Los investigadores informaron en un estudio de prueba de concepto del año 2014 que el dispositivo detectó de manera confiable grandes defectos del campo visual y estuvo de acuerdo con las mediciones del HFA.5Cuando se comparó con el HFA (grupo VirtualEye n=84; grupo HFA n=79), el tiempo promedio de prueba de los pacientes fue de 10.6 ±3.3 minutos y 9.4 ±2.1 minutos para las pruebas de
VirtualEye de agarre manual y visual, en comparación con 6.1 ±1 minuto para las pruebas SITA Standard. - VF2000 (Micro Medical Devices). Un análisis transversal de 97 pacientes utilizando el rendimiento diagnóstico del VF2000 informó una sensibilidad y especificidad del 100% para la clasificación de pacientes como glaucoma o no glaucoma, pero una alta proporción de clasificación errónea de la gravedad del glaucoma.6Alrededor del 28% de los casos moderados se clasificaron erróneamente como leves y el 17% se clasificaron erróneamente como graves; el 20% de los casos graves se clasificaron erróneamente como moderados. La concordancia general entre el VF2000 y el HFA fue de 0.63 en general, 0.76 para el glaucoma leve, 0,37 para el glaucoma moderado y 0,7 para el glaucoma grave.
- AVA Advanced Vision Analyzer (Elisar Vision Technology). Los investigadores realizaron un estudio transversal prospectivo de 160 ojos (85 controles, 75 pacientes con glaucoma) para la evaluación funcional; 15 ojos para la variabilidad de test-retest; y 107 ojos para el ensayo de punto ciego (45 normales, 62 ojos con glaucoma).7 Todos los participantes del estudio se sometieron a las pruebas AVA Elisar Standard Algorithm (ESA) y SITA Standard 24-2. La prueba AVA tomó un poco más de tiempo que el HFA, a 7.08 ±1.55 minutos frente a 6.26 ±0.54 minutos (p=0.228). La diferencia de sensibilidad media sectorial fue de -2,2 ±2,3 dB en controles (p<0,001) y -2,6 ±3,5 dB en pacientes con glaucoma (p<0,001). Para la variabilidad de test-retest, los investigadores encontraron que la variabilidad de respuesta disminuyó con un aumento en la sensibilidad y la excentricidad. Informaron la ubicación precisa del punto ciego, la buena correlación de los índices globales de los métodos de prueba y concluyeron que AVA demostró una “equivalencia sustancial” con el HFA SITA-Standard, y puede evaluar con precisión los campos visuales.
La Dra. Ou dice que los campos visuales de realidad virtual necesitarán un estudio riguroso, pero están listos para convertirse en complementos útiles en la clínica. “Una vez que se ha demostrado que podemos detectar, de forma fiable, la estabilidad y la progresión, estos dispositivos encajarán muy bien en el algoritmo de tratamiento. También pueden ser útiles en pacientes que han tenido una intervención importante, como la cirugía de glaucoma, ya que permitirán la recopilación de más datos de referencia nuevos”.
Seguimiento de la PIO durante todo el día
Una imagen incompleta de la presión ocular de un paciente puede complicar las decisiones de tratamiento. “Hemos comenzado a hacer que los pacientes revisen sus presiones en casa”, dice el Dr. Boland. “Podemos pensar que un paciente está empeorando según las pruebas en la clínica, pero sus presiones parecen estar bien. Ahora estamos encontrando a personas que tienen presiones intraoculares que hacen cosas raras fuera del horario de atención de la clínica, por lo que el seguimiento en el hogar ha sido muy útil”.
Los estudios han informado que la PIO diurna y las fluctuaciones de la PIO pueden ser significativamente más altas que las presiones medidas en el consultorio. En un estudio de 100 pacientes, el 66% tuvo mediciones máximas de la PIO fuera de su cita clínica, con fluctuaciones medias diurnas de la PIO de 7.03 ±2.69 mmHg en comparación con 4.31 ±2.6 mmHg en el consultorio (p<0.003).8
Se ha demostrado que el iCare Home detecta de manera confiable los cambios de la PIO relacionados con la terapia en pacientes con glaucoma e hipertensión ocular, con una fuerte correlación con la tonometría de aplanación Goldmann en el consultorio.9 El entrenamiento remoto también ha mostrado tasas de éxito similares a la enseñanza en persona en el mismo dispositivo.10
El Dr. Boland utiliza un servicio con sede en Utah llamado MyEyes.net que configura a los pacientes con monitores de presión en el hogar. Los pacientes pueden alquilar un tonómetro iCare Home2 por $250 por semana o comprarse uno por $2,995. MyEyes coordina toda la entrega y devolución del dispositivo, eliminando una carga sustancial de las clínicas que desean ofrecer el seguimiento de la presión en el hogar.
Contando células:
Aquí hay dos nuevas formas de contar las células de la retina que algún día pueden ayudar a la detección temprana del daño glaucomatoso:
- Cuantificación de la apoptosis celular. La pérdida de células ganglionares retinianas es una indicación de daño glaucomatoso, pero debe producirse una buena cantidad de daño antes de que se detecte en la OCT o los campos visuales. Ahora, hay una nueva técnica para detectar la pérdida temprana de células ganglionares llamada DARC—Detecting Apoptosing Retinal Cells—, que fue desarrollada por la profesora Francesca M. Cordeiro, profesora y presidenta de oftalmología en el Imperial College de Londres.
¿Cómo funciona DARC? La apoptosis temprana de las células retinianas externaliza la fosfatidilserina, un fosfolípido de la membrana celular, para el cual la proteína anexina A5 tiene una alta afinidad. La anexina marcada con fluorescencia se une a la fosfatidilserina externalizada, y esto hace que las células apoptosas sean visibles en la oftalmoscopia láser de barrido confocal. El grupo de la profesora Cordeiro desarrolló un sistema de inteligencia artificial preciso y reproducible para contar estas células in vivo.
Un estudio que utiliza una red neuronal convolucional (el 97% de precisión, el 91,1% de sensibilidad, el 97,1% de especificidad) para contar las células en 40 controles y 20 pacientes con glaucoma informó un número significativamente mayor de apoptosis de células ganglionares de la retina en pacientes que más tarde progresaron en la OCT (p=0,0044).11 Además, se está investigando DARC para atrofia geográfica y DMAE. Se está desarrollando una vía de administración de anexina intranasal, que los investigadores dicen que puede ampliar la adopción de la tecnología (en comparación con la vía intravenosa bien tolerada).12 Los ensayos clínicos de Fase II se completaron el año pasado.
- Óptica adaptativa. El emparejamiento de la OCT con óptica adaptativa, una técnica que mejora la capacidad de un sistema óptico para captar detalles finos al reducir las distorsiones del frente de onda entrante, puede ofrecer otro medio para contar las células retinianas in vivo. Al igual que con DARC, un algoritmo de inteligencia artificial está en desarrollo para asumir la carga de contar células. En un estudio que utilizó un algoritmo de deep learning para segmentar y medir el soma de la capa de células ganglionares con imágenes de OCT de óptica adaptativa, los investigadores informaron que los diámetros del soma de los pacientes con glaucoma eran mayores que los de los controles y que había una fuerte correlación lineal entre la densidad de la capa de las células ganglionares locales y el espesor medido. También informaron un aumento en la correlación estructura-función de los pacientes con glaucoma al usar el sistema de IA en comparación con las mediciones de espesor de la OCT.13
Perlas para el éxito
Monitorear el glaucoma e identificar la progresión es un desafío. Estos son algunos consejos a tener en cuenta:
- Las pantallas de progresión no muestran dónde se produce el daño. El software de análisis utiliza parámetros globales como el espesor medio de la RNFL y la desviación media. “No debe confiar demasiado en estas métricas o parámetros porque puede haber cambios localizados”, dice la Dra. Ou. “Digamos que haya un adelgazamiento localizado de la RNFL o la profundización localizada de un escotoma. Esos se perderán si solo confía en las métricas globales”.
- Estar atento a la hemorragia del nervio óptico.
“Por mucho que dependamos de la OCT, el instrumento no detectará una hemorragia del nervio óptico”, dice el Dr. Aref. “La hemorragia del nervio óptico es un marcador de progresión, y si se encuentra, puede tener implicaciones significativas sobre cómo se trata a un paciente. Recuerde examinar el nervio óptico y buscar específicamente una hemorragia”. - No tenga miedo de repetir las pruebas. “Si sospecha que un paciente está empeorando, lo mejor que puede hacer antes de avanzar en la terapia, a menos que sea obvio que está empeorando, es repetir la prueba en un corto período”, dice el Dr. Mansberger.
La Dra. Ou está de acuerdo: “Siempre vuelva a verificar los campos visuales para confirmar el cambio que ve, antes de avanzar en el tratamiento, especialmente las cirugías como la trabeculectomía o las derivaciones tubulares”.
- Confíe en el software de análisis. “Puede confiar en estos sofisticados paquetes de software”, dice el Dr. Aref. “Son más útiles que revisar las pruebas individuales por su cuenta y elaborar criterios de progresión. Simplemente no tenemos la capacidad de tener en cuenta todo lo que hace un algoritmo, especialmente en una clínica de alto volumen”.
- Conozca el piso de su dispositivo. El piso difiere entre los instrumentos de OCT, ya que cada plataforma tiene sus propios algoritmos para calcular el espesor de la RNFL. “Asegúrese de conocer el piso de su dispositivo, así como el deterioro esperado relacionado con la edad de su sistema, lo que se puede encontrar en la literatura”, dice la Dra. Ou.
Los doctores Ou, Aref y Mansberger no tienen revelaciones financieras relacionadas. El Dr. Boland es consultor de Zeiss, Topcon, Janssen Pharmaceuticals y Allergan.