(Este artículo fue traducido, adaptado e impreso con autorización exclusiva del grupo de revistas de Review de Jobson Medical Information. Su reproducción está prohibida).
Por Christopher Kent, editor sénior
Las nuevas tecnologías se muestran prometedoras para un monitoreo y pronóstico más precisos de la progresión.
Diagnosticar el glaucoma y detectar la progresión son tareas desafiantes. Pero a medida que la tecnología avanza con persistencia, siguen apareciendo nuevas formas de lograr estos objetivos. Aquí hay tres opciones desarrolladas, recientemente, que muestran su gran potencial.
Detección de células muertas
Como se sabe, la pérdida de células ganglionares de la retina es una indicación temprana de daño glaucomatoso. Los dos métodos más comunes de monitoreo del daño glaucomatoso (campos visuales y OCT) normalmente no detectan el daño hasta que ya se haya producido una buena cantidad de deterioro (especialmente los campos visuales, que requieren que entre el 20% y el 40% de las células de la retina se dañen antes de que sea detectable). Por lo tanto, es deseable encontrar formas alternativas de detectar signos de daño como un medio para permitir el tratamiento más temprano de los pacientes en riesgo.
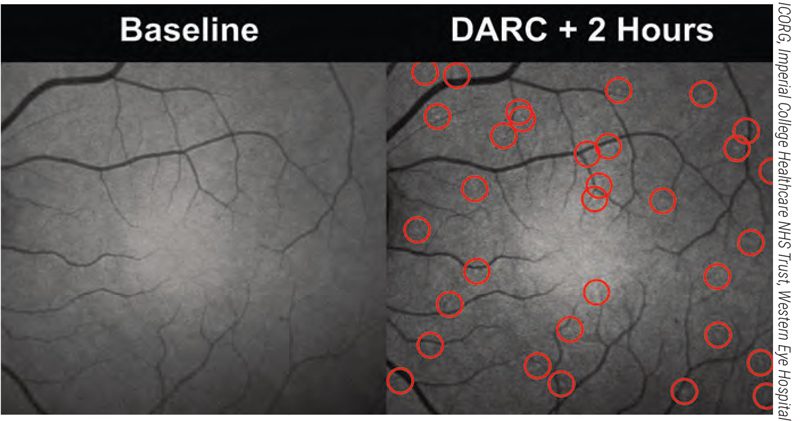
Una forma única de determinar la condición de las células retinianas de un paciente se llama DARC (Detection of Apoptosing Retinal Cells). Cuando las células de la retina se encuentran en las primeras etapas de la apoptosis exteriorizan un fosfolípido de la membrana celular llamado fosfatidilserina. La anexina A5 es una proteína que tiene una alta afinidad con la fosfatidilserina. En la técnica DARC, desarrollada por Francesca Cordeiro – profesora de oftalmología en el Instituto de Oftalmología de la UCL y catedrática de oftalmología en el Imperial College de Londres –, la anexina marcada con fluorescencia se une a la fosfatidilserina que las células externalizan en las primeras etapas de la apoptosis. Esto las hace visibles, por lo que se pueden visualizar y medir mediante la oftalmoscopia láser de barrido confocal. Esto brinda a los investigadores una forma de cuantificar la cantidad de células de la retina que comienzan a morir, in vivo.1-6 Originalmente, la anexina DARC se administraba por vía intravenosa; ahora se está desarrollando una forma de aplicarla por vía intranasal. (En múltiples ensayos, en los que participaron 129 pacientes, se encontró que la anexina intravenosa es segura y bien tolerada).
Como se puede imaginar, un desafío al evaluar el estado de la retina mediante DARC es contar las células marcadas en las imágenes capturadas. Contarlas manualmente lleva mucho tiempo, requiere mucho trabajo y muestra una variabilidad inter e intraoperatoria considerable.2 En respuesta a ello, el grupo del Prof. Cordeiro ha desarrollado un sistema que usa inteligencia artificial para hacer el conteo. La comparación de conteos manuales y automatizados usando 66 imágenes DARC mostró que los conteos automatizados son precisos y altamente comparables al conteo manual, mientras que más rápidos y reproducibles. En otro estudio más reciente con 60 imágenes y el uso de redes neuronales convolucionales, un algoritmo demostró una sensibilidad del 85,7% y una especificidad del 91,7 % en comparación con el conteo manual.4
Además, este estudio encontró un conteo significativamente mayor de DARC en pacientes que más tarde siguieron a OCT (p= 0.0044). Este resultado se basó en una pequeña muestra de pacientes, por lo que deberá ser confirmado por estudios más amplios en el futuro. En uno de los estudios, los investigadores4 también observaron la edad de referencia, el espesor de la córnea central, la presión arterial, la desviación media del campo visual, el índice del campo visual y el espesor promedio de la RNFL; ninguno de estos resultó ser un predictor significativo de progresión futura. (Sin embargo, encontraron un parámetro de OCT que se correlacionó significativamente con la progresión futura [p=0.045]: los sectores anormales correspondientes topográficamente de referencia en imágenes de OCT RNFL y BMO-MRW).
El enfoque DARC ha estado en desarrollo durante dos décadas y recientemente completó los ensayos clínicos de Fase II. Aunque originalmente se probó en modelos de glaucoma preclínico y neuropatía óptica, también se lo está probando como una herramienta potencial para monitorear la atrofia geográfica, la degeneración macular, el Alzheimer, el Parkinson y la diabetes, así como para evaluar la eficacia de las terapias.
“DARC es una nueva y emocionante tecnología capaz de ofrecer medicamentos personalizados para enfermedades oculares y más allá”, dice el Prof. Cordeiro. “Ser capaz no solo de tratar las enfermedades antes de un deterioro importante de la función, sino también de monitorear la eficacia del tratamiento, ayudará a minimizar el impacto de la enfermedad en la calidad de vida del paciente.
“Además de las mejoras en la atención médica del paciente, DARC puede acelerar el progreso de los ensayos clínicos”, añade. “Se puede utilizar para enriquecer las poblaciones de pacientes en estudios mediante la identificación de individuos que expresan un alto estrés de las células de la retina. Además, la señal DARC se puede utilizar como un criterio de valoración clínico para evaluar el grado en que el tratamiento fue capaz de reducir la apoptosis en el ojo”.
Contando células: óptica adaptativa
El uso clínico actual de la OCT para diagnosticar o monitorear la progresión del glaucoma se basa en la medición del espesor de las capas retinianas como un sustituto para el número de células retinianas sanas. Claramente, este es un sustituto imperfecto para un cómputo de células real, lo que puede explicar (al menos en parte) la conocida falta de correlación perfecta entre las mediciones del campo visual funcional y las mediciones de OCT.

Los investigadores están desarrollando formas de hacer un conteo real de las células presentes en imágenes in vivo de la retina utilizando óptica adaptativa, lo que mejora la resolución limitada de los sistemas de imágenes estándar. El uso de este enfoque se ha visto limitado por el proceso subjetivo y lento de marcación manual, lo que lo ha hecho impracticable para el uso clínico y los estudios de gran envergadura. Por lo tanto, los investigadores ahora buscan el uso de IA para automatizar este proceso.
Un estudio reciente de la profesora Sina Farsiu (Universidad Duke, en Durham, Carolina del Norte) y sus colegas aportó una actualización sobre este trabajo.7 El grupo está utilizando lo que se llama “weakly supervised deep learning” (‘aprendizaje profundo débilmente supervisado’), o WeakGCSeg, para entrenar la IA para segmentar y medir los somas de la capa de células ganglionares a través de imágenes de OCT de óptica adaptativa. (“Débilmente supervisado” se refiere a “anotaciones débiles” – puntos de clic humanos utilizados en el proceso de entrenamiento para obtener máscaras de segmentación con un esfuerzo mínimo).
Sus resultados indican que WeakGCSeg es al menos tan bueno como los expertos humanos en esta operación y superior a otras redes de IA que se han intentado hasta la fecha. Logró un alto rendimiento de detección y estimaciones precisas del diámetro del soma. La cantidad de tiempo ahorrado en comparación con el marcado manual fue significativa: el marcado manual tomó entre siete y ocho horas por volumen, WeakGCSeg lo hizo en menos de tres minutos por volumen. Además, su sistema fue capaz de lograr un alto rendimiento independientemente del dispositivo de imagen utilizado o la presencia de patología o excentricidad retiniana.
Otros hallazgos incluyeron:
- Los diámetros del soma en ojos de sujetos con glaucoma eran mayores que en ojos sanos.
- Hubo una fuerte correlación lineal entre la densidad de la capa de células ganglionares locales y el espesor medido. (Los valores de espesor medidos por la OCT clínica generalmente no se correlacionan bien con la densidad celular local).
- Se encontró un aumento en la correlación entre la estructura y la función (según lo medido por el campo visual) para los pacientes con glaucoma, cuando se utiliza WeakCGSeg en lugar de mediciones de espesor OCT.
En estudios futuros, los autores esperan investigar la relación estructura-función en diferentes niveles de enfermedad utilizando el sistema WeakCGSeg. Mientras tanto, esperan que este sistema pueda hacer que los ensayos clínicos a gran escala y multisitio sean factibles, lo que conducirá a una comprensión mucho mayor de las enfermedades que involucran la patología de la retina.
Nuevas iteraciones de perimetría
La medición de la función visual de un paciente con perimetría siempre ha sido una parte crucial del diagnóstico y monitoreo del glaucoma. Sin embargo, a pesar de las mejoras en la prueba con el tiempo, incluida la disponibilidad actual de múltiples variaciones en los patrones de prueba, la estrategia de prueba y el tamaño del estímulo, la prueba estándar requiere que el paciente venga al consultorio y mire fijamente a una máquina durante varios minutos. Como todo oftalmólogo sabe, esta no es la experiencia de prueba favorita de nadie. Y en términos de recopilación de datos significativos, puede haber problemas con la capacidad de atención del paciente, la fatiga y la comprensión de las instrucciones, entre otras cuestiones. Además, estas pruebas solo se realizan dos veces al año como máximo, en circunstancias ordinarias, por una serie de razones (incluida la necesidad del paciente ir al consultorio para hacerse la prueba).
Con el advenimiento de la tecnología digital, se están desarrollando nuevas opciones para probar el campo visual que no requieren el desplazamiento al consultorio o meter la cara en una máquina estacionaria. En particular, las pruebas de campo visual ahora se pueden realizar utilizando una tableta o un casco de realidad virtual. La desventaja de estas opciones es la posibilidad de recopilar datos menos precisos; el factor de compensación es que debido a que tales pruebas se pueden realizar fuera del consultorio – y son más fáciles y divertidas para el paciente – se pueden repetir con mucha más frecuencia. Estadísticamente hablando, tener de modo significativo más datos de baja resolución puede ser tan útil como tener datos de alta resolución menos frecuentes.
En términos de pruebas con la tableta, una de las más conocidas es la Prueba de Campos Rápidos de Melbourne, disponible como una aplicación gratuita para iPad llamada “visualFields easy” (https://itunes.apple.com/us/app/visualfields-easy/id495389227 ).
La prueba utiliza un objetivo de fijación móvil para ensayar hasta 30 grados del campo visual. Los estudios clínicos han indicado que tiene una buena repetibilidad de prueba a prueba y se correlaciona bien con las pruebas de campo visual de Humphrey.8
Una limitación obvia del uso de la tableta para este tipo de prueba es la incapacidad de controlar la distancia desde el ojo hasta la pantalla, así como no haber manera de monitorear el nivel de fijación precisa del paciente. Las pruebas con cascos de realidad virtual pueden resolver esos problemas mediante el seguimiento de la mirada. Esencialmente, el estímulo se puede mostrar en la posición apropiada en relación con la fijación sin importar dónde esté mirando el paciente. (Los giroscopios explican el movimiento de la cabeza). Otras ventajas incluyen una mejor participación del usuario debido al entorno de inmersión y la capacidad de probar un ojo a la vez sin parchear el otro.
Varios de estos dispositivos están ahora disponibles, incluyendo el VisuALL, de Olleyes, ( olleyes.com ), que también puede probar agudeza visual, visión de color y sensibilidad de contraste; Vivid Vision ( seevividly.com ); Virtual Field (Virtual Field/Lombart); VirtualEye Perimeter, de BioFormatix, (bioformatix.com/perimetry.html ); PalmScan VF2000, de MicroMedical Devices, (micromedinc.com/our-devices/palmscan-vf2000-visual-field-perimeter ); y eCloudimeter, de Elisar, (elisar.com). Otro dispositivo en desarrollo es el nGoggle, un casco de realidad virtual que incluye sensores EEG integrados que pueden detectar cuando el paciente está viendo el estímulo, lo que elimina la necesidad de que el paciente use un dispositivo manual como un clicker para indicar que se vio un estímulo ( ngoggle.com/product ).
Felipe A. Medeiros, MD, PhD, profesor distinguido de oftalmología, director de investigación clínica y vicepresidente de tecnología en la Universidad de Duke, señala que, según a lo mejor de su conocimiento, todas estas nuevas alternativas carecen de validación a largo plazo de su capacidad potencial para detectar la progresión del glaucoma a lo largo del tiempo. “Estudios como el estudio Vingrys8 del software de campo visual basado en tabletas han demostrado una buena concordancia con la prueba de Humphrey y una buena reproducibilidad”, señala. “Estos dispositivos pueden permitir pruebas más frecuentes, lo que sería una adición muy bienvenida, pero todavía necesitan validación como herramientas para la detección de la progresión”.
Bibliografía
- Cordeiro MF, Hill D, Patel R, Corazza P, et al. Detecting retinal cell stress and apoptosis with DARC: Progression from lab to clinic. Prog Retin Eye Res 2022;86:100976.
- Bizrah M, Dakin SC, Guo L, Rahman F, et al. A semi-automated technique for labeling and counting of apoptosing retinal cells. BMC Bioinformatics 2014;515:169.
- Guo L, Cordeiro MF. Assessment of neuroprotection in the retina with DARC. Prog Brain Res 2008;173:437-50.
- Normando EM, Yap TE, Maddison J, et al. A CNN-aided method to predict glaucoma progression using DARC (Detection of Apoptosing Retinal Cells). Expert Rev Mol Diagn 2020;7:737-748.
- Normando EM, Dehabadi MH, Guo L, et al. Real-time imaging of retinal cell apoptosis by confocal scanning laser ophthalmoscopy. Methods Mol Biol 2015;1254:227-37.
- Yap TE, Davis BM, Guo L, et al. Annexins in Glaucoma. Int J Mol Sci 2018;19:4:1218.
- Soltanian-Zadeh S, Kurokawa K, Liu Z, et al. Weakly supervised individual ganglion cell segmentation from adaptive optics OCT images for glaucomatous damage assessment. Optica 2021;8:5:642-651.
- 6. Prea SM, Kong YXG, Mehta A, et al. Six-month longitudinal comparison of a portable tablet perimeter with the Humphrey Field Analyzer. Am J Ophthalmol 2018;190:9-16.












