
Autores: Dr. Fernando Gómez Goyeneche, Dra. Laura Zarate Pinzón, Dra. Natalia Guarnizo, Dra. María Alejandra Villamil Forero
Correspondencia del autor:
Fernando Gómez Goyeneche
Oftalmólogo glaucomatólogo
Diagnóstico Ocular del Country
Email: hfgomezgol@gmail.com
Número de teléfono: +57 315 3213460
Dirección: Cra. 16 #82-95 Consultorio 703, Bogotá
Introducción
La miopía es un defecto refractivo caracterizado por la incapacidad de visualizar objetos distantes (1). Su prevalencia ha aumentado en las últimas décadas, y se estima que para el año 2050 afectará aproximadamente al 50 % de la población mundial, representando un desafío para la salud pública (2,3). Adicionalmente, se asocia a complicaciones que pueden derivar en ceguera irreversible, como la degeneración macular, el desprendimiento de retina y el glaucoma (3,4).
Esta condición constituye un factor de riesgo independiente para el desarrollo de glaucoma primario de ángulo abierto, con un aumento estimado del 20 % en el riesgo por cada dioptría adicional (2). Diferenciar entre las modificaciones propias de la miopía y los signos tempranos de glaucoma puede ser complejo, ya que ambas entidades comparten hallazgos como inclinación, torsión u ovalización del disco óptico, mayor excavación y atrofia peripapilar (3,5–7), evidentes en la fotografía de fondo de ojo (8).
Adicionalmente, se ha reportado que hasta el 63 % de los pacientes miopes presentan defectos en el campo visual computarizado (CVC), los cuales se correlacionan con alteraciones estructurales en la lámina cribosa (9), así como con cambios en la tomografía de coherencia óptica (OCT), como el adelgazamiento macular del complejo de células ganglionares (CCG) (5).
La elongación axial genera cambios estructurales, como deformación de la lámina cribosa, mayor tensión escleral y adelgazamiento del tejido, que incrementan la susceptibilidad al daño glaucomatoso (5). En este contexto, el uso de bases normativas ajustadas por longitud axial, integradas en los equipos RS-3000 Advance 2 y RS-1, ha demostrado mejorar la precisión diagnóstica y reducir la tasa de falsos positivos en ojos miopes (10,11).
La combinación de estas herramientas imagenológicas con una evaluación clínica minuciosa es esencial para establecer un diagnóstico diferencial preciso entre miopía y glaucoma (12). A continuación, se presenta el caso de una paciente con miopía patológica remitida por sospecha de glaucoma, en quien la correlación estructural y funcional fue determinante para la realización de un diagnóstico diferencial adecuado.
Reporte de caso
Paciente femenina de 62 años con diagnóstico de miopía patológica, con refracción de OD: -22.00 -1.50 x 30 y OI: -22.50 -1.00 x 109, paquimetrías de 396/392 μm y longitudes axiales de 31.32/30.53 mm. Antecedentes: OD con desprendimiento de retina y AO con membrana neovascular tratada con agentes antiangiogénicos, además de cirugía de facoemulsificación con implante de lente intraocular.
Consultó por primera vez a nuestro servicio en 2016 por sospecha de glaucoma. Se registró una agudeza visual corregida con corrección (AVCC) de 20/40 en OD y 20/30 en OI. La biomicroscopía anterior no mostró alteraciones, con presión intraocular (PIO) en ambos ojos (AO) de 18 mmHg. En el examen de fondo de ojo AO se observaron discos ópticos inclinados con excavaciones de 0.1, estafiloma posterior tipo 1 según la clasificación de Curtin (13), de mayor extensión en OD, así como signos de maculopatía miópica con componente atrófico grado 3, sin evidencia de tracción ni de neovascularización activa (14). Sin embargo, en OD se identificaron dos áreas de atrofia coriorretiniana en relación con membrana neovascular antigua, mientras que en OI no hubo evidencia de cicatrices (Figura 1).
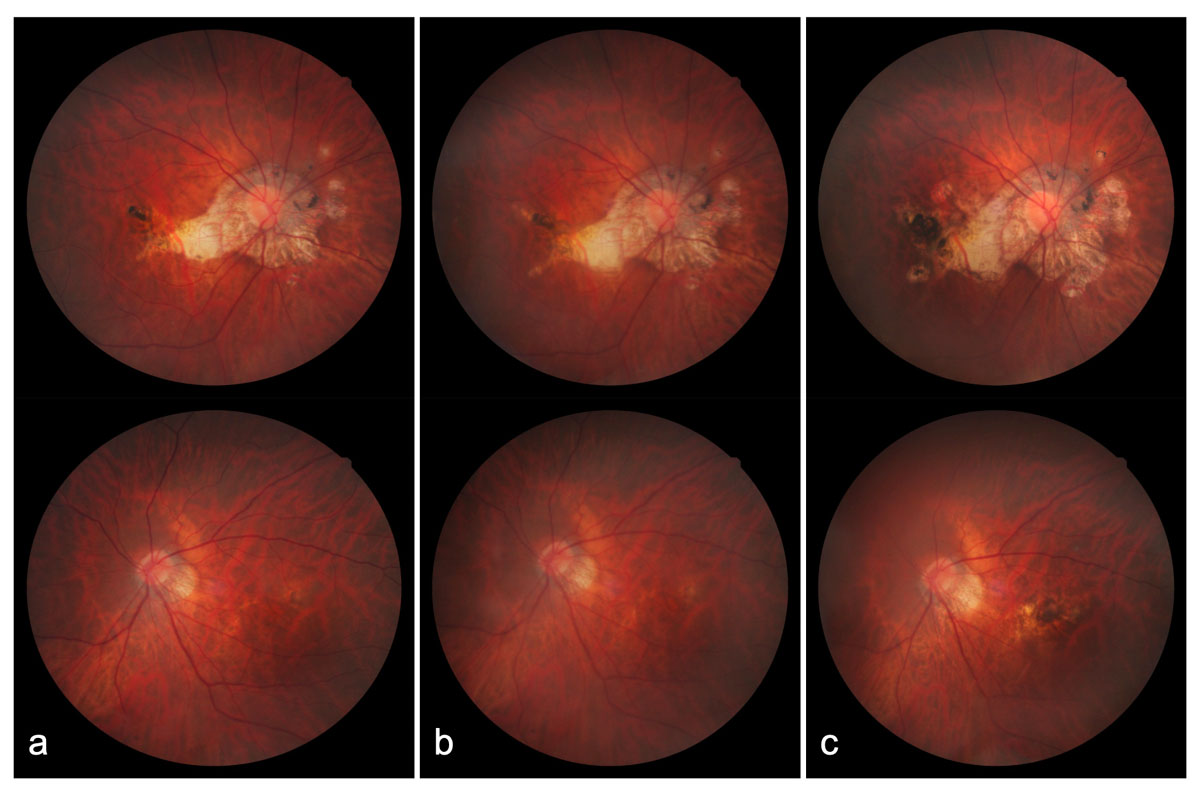
Figura 1: seguimiento fotográfico del fondo de ojo. Medios claros. Discos ópticos inclinados con excavaciones de 0.1 en ambos ojos (AO). Se observa estafiloma posterior tipo 1, de mayor extensión en OD, así como maculopatía miópica con componente atrófico grado 3, sin evidencia de tracción vitreorretiniana ni de neovascularización activa. En OD se identifican dos áreas de atrofia coriorretiniana en relación con membrana neovascular antigua. Se documenta progresión del componente atrófico hacia la región macular en ambos ojos. a) 2016; b) 2019; c) 2025.
Con el fin de descartar daño glaucomatoso, se solicitó OCT de nervio óptico y CCG, así como CVC 24-2C. El OCT, realizado con el equipo NIDEK RS-3000 Advance 2 ajustado a la base normativa de longitud axial, evidenció en ambos ojos (AO) adelgazamiento de la CCG y de la capa de fibras nerviosas (Figura 2). En el CVC de OD se evidenció la presencia de defectos peripapilares, mientras que en OI se observaron hallazgos inespecíficos, sin cumplir criterios diagnósticos de neuropatía óptica glaucomatosa (Figura 3).
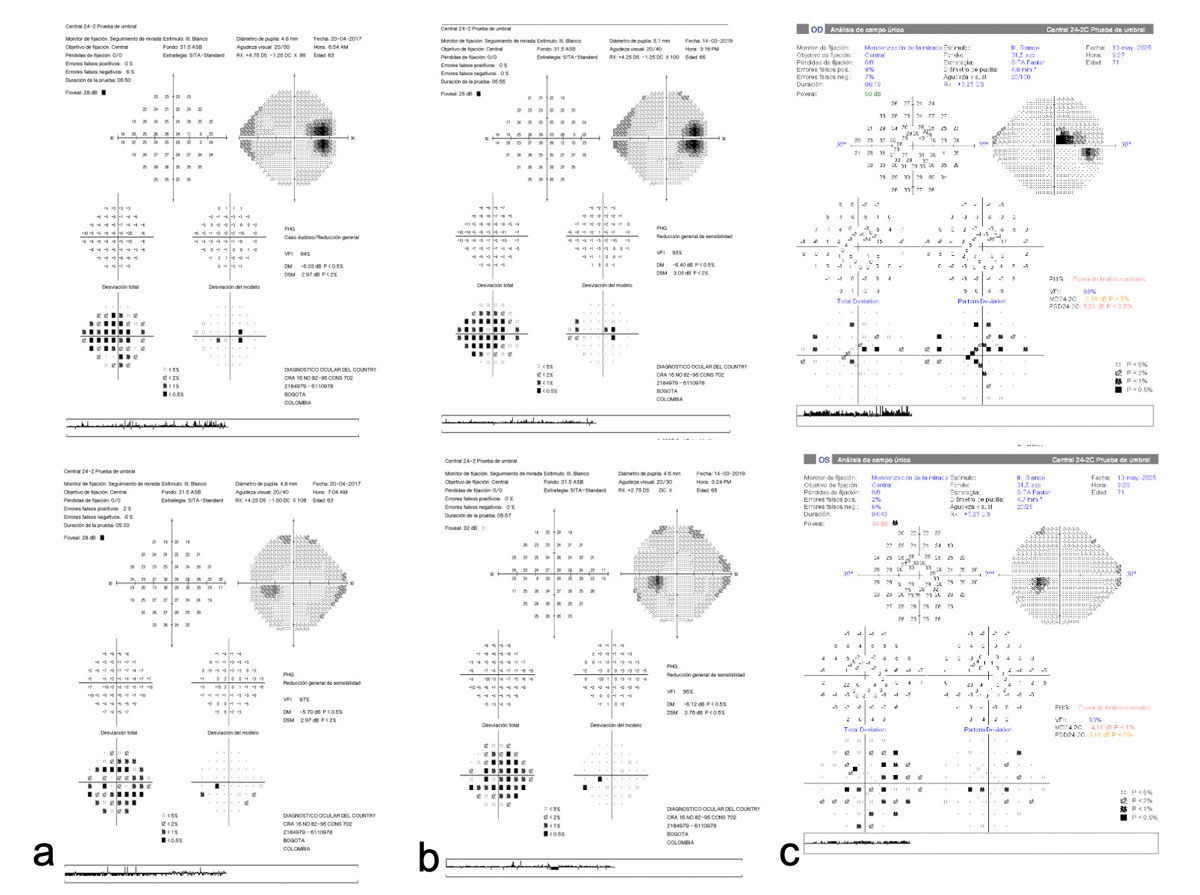
Figura 3. Campimetría visual computarizada 24-2C. Se evidencia una disminución generalizada de la sensibilidad visual, con deterioro campimétrico y aumento de defectos peripapilares, centrales y paracentrales en ambos ojos (AO). a) 2016; b) 2019; c) 2025.
En 2019, la paciente presentó un nuevo episodio en AO de neovascularización coroidea, tratado con inyecciones intravítreas de antiangiogénicos. En 2023, se evidenció AO hipertensión ocular, con PIO de 22/24 mmHg; por lo que, se inició tratamiento tópico con dorzolamida 2% y timolol 0.5%, cada 12 horas. En 2024, se realizó AO trabeculoplastia selectiva con láser para optimizar el control de PIO y se continuo con tratamiento hipotensor.
En el seguimiento de 2025, nueve años después de su primera valoración. Paciente con AVcc OD 20/100 y OI 20/30, AO sin alteraciones en biomicroscopia y con PIO 15/15 mmHg. En el examen de fondo de ojo AO, se observó progresión de la maculopatía miópica por extensión del componente atrófico, áreas de atrofia coriorretiniana y coroidosis miópica, sin evidencia de progresión estructural del nervio óptico ni signos compatibles con neuropatía óptica glaucomatosa (Figura 1). El CVC 24-2C evidenció en OD defectos peripapilares y paracentrales superiores, y en OI defecto inespecífico, atribuibles a la patología miópica (Figura 2). La paciente permanece en seguimiento semestral.
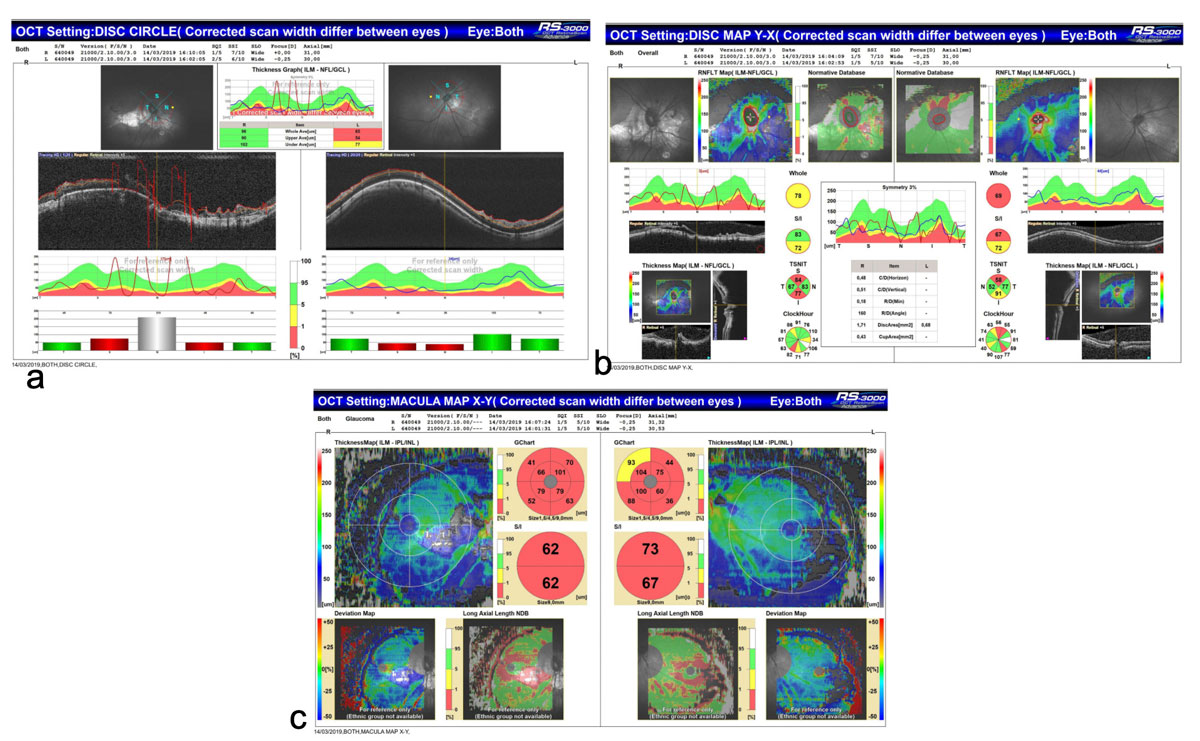
Figura 2. Tomografía de coherencia óptica de nervio óptico y capa de células ganglionares.
OCT obtenido con el equipo NIDEK RS-3000 Advance 2, ajustado a la base normativa de longitud axial, que muestra adelgazamiento en la capa de células ganglionares y en la capa de fibras nerviosas. Los hallazgos fueron considerados no concluyentes debido a la morfología del disco óptico, errores en la segmentación y numerosos artefactos periféricos debido a la longitud axial a) mapa circulo de disco, b) mapa de disco c) mapa macular.
Discusión
Los pacientes con miopía, especialmente aquellos con miopía alta, requieren un enfoque clínico integral orientado a prevenir la progresión de la enfermedad, la aparición de complicaciones y la pérdida de agudeza visual (15). Para ello, es fundamental realizar un abordaje integral que incluya una evaluación clínica completa y el uso de herramientas diagnósticas como la tonometría, fotografía de fondo de ojo, CVC, OCT de nervio óptico y CCG, así como angio-OCT (OCT-A) (5).
La miopía alta, definida como un equivalente esférico ≤–6 dioptrías o una longitud axial ≥26.5 mm, se reconoce como un factor de riesgo para el desarrollo y la progresión del glaucoma de ángulo abierto (2,5). Los cambios estructurales inducidos por la elongación axial, como la inclinación y la ovalización del disco óptico, pueden imitar signos típicos de la neuropatía óptica glaucomatosa, lo que dificulta su diagnóstico diferencial (16).
Presentamos el caso de una paciente con miopía alta, referida por sospecha de glaucoma. El examen clínico reveló un disco óptico notablemente inclinado y ovalado, con excavación mínima, presencia de estafiloma posterior y antecedentes de desprendimiento de retina y neovascularización coroidea. Estos hallazgos orientaron el diagnóstico hacia una miopía patológica como la principal causa de las alteraciones estructurales observadas.
El uso de bases normativas ajustadas por longitud axial en la OCT ha demostrado disminuir la tasa de falsos positivos en el diagnóstico de glaucoma en pacientes con miopía (10,11). No obstante, en este caso específico se evidenció un adelgazamiento de la capa de fibras nerviosas y de la CCG, hallazgo que no puede considerarse confiable debido a la marcada inclinación del disco óptico. Además, la longitud axial de la paciente excede los valores contemplados en la base normativa, lo que puede generar artefactos y errores en la segmentación (17). Esta limitación obligó a complementar la evaluación con otras herramientas diagnósticas, como la fotografía de fondo de ojo, el CVC y las paquimetrías.
La fotografía de fondo de ojo se ha consolidado como una herramienta útil, accesible y costo-efectiva para el seguimiento estructural del nervio óptico y la capa de fibras nerviosas en pacientes con miopía (8). Su aplicación se ha extendido al desarrollo de algoritmos de inteligencia artificial, alcanzando sensibilidades y especificidades superiores al 90% para la detección de glaucoma (18–20). En este contexto, resulta fundamental diferenciar los hallazgos estructurales propios de la miopía de aquellos característicos de la neuropatía óptica glaucomatosa.
En el glaucoma, los hallazgos típicos incluyen defectos en cuña de la capa de fibras nerviosas, comúnmente localizados en los sectores ínfero o superotemporales del nervio óptico, respetando la región central hasta estadios avanzados. También son frecuentes la nasalización de los vasos centrales, la configuración en bayoneta de los vasos y la profundización de la excavación (5,16). En contraste, en la miopía alta suelen observarse alteraciones en la región papilomacular, acompañadas de torsión e inclinación del disco óptico (5,16,21). En el caso presentado, se observó una marcada inclinación y ovalización del disco óptico, con excavación leve y presencia de estafiloma posterior, hallazgos que orientan el diagnóstico hacia una miopía patológica.
El CVC también representa un reto en estos pacientes, ya que la miopía puede simular patrones glaucomatosos, como escalones nasales, defectos paracentrales y arqueados (8,22). En el glaucoma, predominan los escotomas paracentrales, los defectos en cuña y, en etapas tardías, la visión en túnel (16). En cambio, los pacientes miopes presentan, con mayor frecuencia, depresiones generalizadas, ampliación de la mancha ciega y defectos centrales o paracentrales, que pueden progresar con el tiempo (23). En el caso presentado, los CVC mostraron defectos generalizados y paracentrales inespecíficos, con evidencia de progresión e indicios compatibles con miopía patológica.
La medición del grosor corneal central es esencial en la evaluación del glaucoma, ya que influye directamente en la precisión de las mediciones de la presión intraocular (PIO) (24). Las córneas gruesas tienden a sobrestimar la PIO, mientras que las córneas delgadas la subestiman (25). Los pacientes miopes suelen presentar córneas más delgadas (24), lo que se asocia a una menor rigidez ocular y, por ende, a una deformación aumentada que podría contribuir a una mayor susceptibilidad al daño glaucomatoso (26). Por ello, la realización de paquimetría es fundamental para ajustar correctamente los valores de PIO.
En el presente caso, la paciente presentó córneas delgadas y, tras desarrollar hipertensión ocular, fue tratada mediante trabeculoplastia láser selectiva y medicación tópica, logrando un control efectivo de la presión intraocular (PIO) durante el primer año de seguimiento. Se continuará el seguimiento con controles oftalmológicos semestrales que incluyan medición de PIO, fotografía de fondo de ojo y campimetría visual computarizada (CVC).
Este caso resalta las dificultades diagnósticas en la evaluación del glaucoma en pacientes con miopía alta. Ante la limitada confiabilidad de algunas pruebas debido a las alteraciones morfológicas del globo ocular, es fundamental adoptar un enfoque diagnóstico multimodal que combine evaluación clínica, fotografía de fondo de ojo y campimetría visual. Reconocer los patrones específicos de daño estructural y funcional propios de la miopía patológica es clave para evitar el sobrediagnóstico de glaucoma y orientar decisiones terapéuticas informadas y basadas en evidencia.
Referencias bibliográficas
- Baird PN, Saw SM, Lanca C, Guggenheim JA, Smith Iii EL, Zhou X, et al. Myopia. Nat Rev Dis Primers. el 17 de diciembre de 2020;6(1):99.
- Ha A, Kim CY, Shim SR, Chang IB, Kim YK. Degree of Myopia and Glaucoma Risk: A Dose-Response Meta-analysis. American Journal of Ophthalmology. abril de 2022;236:107–19.
- Holden BA, Fricke TR, Wilson DA, Jong M, Naidoo KS, Sankaridurg P, et al. Global Prevalence of Myopia and High Myopia and Temporal Trends from 2000 through 2050. Ophthalmology. mayo de 2016;123(5):1036–42.
- Haarman AEG, Enthoven CA, Tideman JWL, Tedja MS, Verhoeven VJM, Klaver CCW. The Complications of Myopia: A Review and Meta-Analysis. Invest Ophthalmol Vis Sci. el 29 de abril de 2020;61(4):49.
- Sun MT, Tran M, Singh K, Chang R, Wang H, Sun Y. Glaucoma and Myopia: Diagnostic Challenges. Biomolecules. el 20 de marzo de 2023;13(3):562.
- Kita Y, Kita R, Takeyama A, Tomita G, Goldberg I. Effect of high myopia on glaucoma diagnostic parameters measured with optical coherence tomography. Clinical Exper Ophthalmology. noviembre de 2014;42(8):722–8.
- Zhang XJ, Lai CHY, Shih KC. Beyond Spherical Equivalent and Axial Length in Myopia. JAMA Ophthalmol [Internet]. el 5 de junio de 2025 [citado el 27 de junio de 2025]; Disponible en: https://jamanetwork.com/journals/jamaophthalmology/fullarticle/2834965
- Jiravarnsirikul A, Belghith A, Rezapour J, Bowd C, Moghimi S, Jonas JB, et al. Evaluating glaucoma in myopic eyes: Challenges and opportunities. Survey of Ophthalmology. mayo de 2025;70(3):563–82.
- Xie S, Kamoi K, Igarashi-Yokoi T, Uramoto K, Takahashi H, Nakao N, et al. Structural Abnormalities in the Papillary and Peripapillary Areas and Corresponding Visual Field Defects in Eyes With Pathologic Myopia. Invest Ophthalmol Vis Sci. el 21 de abril de 2022;63(4):13.
- Chen HSL, Ling XC, Lu DW, Chuang LH, Su WW, Lee YS, et al. Glaucoma diagnostic performance of macular ganglion cell complex thickness using regular and long axial length normative databases. Sci Rep. el 4 de julio de 2022;12(1):11263.
- Chang YF, Ko YC, Hsu CC, Chen MJ, Liu CJL. Glaucoma assessment in high myopic eyes using optical coherence tomography with long axial length normative database. Journal of the Chinese Medical Association. marzo de 2020;83(3):313–7.
- Gifford KL, Richdale K, Kang P, Aller TA, Lam CS, Liu YM, et al. IMI – Clinical Management Guidelines Report. Invest Ophthalmol Vis Sci. el 1 de febrero de 2019;60(3):M184.
- Yoon CK, Lee EK, Bae K, Park UC. Clinical features of primary and compound forms of wide macular posterior staphyloma in high myopia. BMC Ophthalmol. el 11 de junio de 2024;24(1):246.
- Ruiz-Medrano J, Flores-Moreno I, Ohno-Matsui K, Cheung CMG, Silva R, Ruiz-Moreno JM. CORRELATION BETWEEN ATROPHY-TRACTION-NEOVASCULARIZATION GRADE FOR MYOPIC MACULOPATHY AND CLINICAL SEVERITY. Retina. septiembre de 2021;41(9):1867–73.
- Bullimore MA, Ritchey ER, Shah S, Leveziel N, Bourne RRA, Flitcroft DI. The Risks and Benefits of Myopia Control. Ophthalmology. noviembre de 2021;128(11):1561–79.
- Zhang X, Jiang J, Kong K, Li F, Chen S, Wang P, et al. Optic neuropathy in high myopia: Glaucoma or high myopia or both? Progress in Retinal and Eye Research. marzo de 2024;99:101246.
- NIDEK [Internet]. [citado el 30 de junio de 2025]. Software for NIDEK OCT series Long Axial Length Normative Database | NIDEK. Disponible en: https://www.nidek.co.jp/
- Liu H, Li L, Wormstone IM, Qiao C, Zhang C, Liu P, et al. Development and Validation of a Deep Learning System to Detect Glaucomatous Optic Neuropathy Using Fundus Photographs. JAMA Ophthalmol. el 1 de diciembre de 2019;137(12):1353.
- Li Z, He Y, Keel S, Meng W, Chang RT, He M. Efficacy of a Deep Learning System for Detecting Glaucomatous Optic Neuropathy Based on Color Fundus Photographs. Ophthalmology. agosto de 2018;125(8):1199–206.
- Meng J, Song Y, He W, Lu ZL, Chen Y, Wei L, et al. A Novel Artificial Intelligence-Based Classification of Highly Myopic Eyes Based on Visual Function and Fundus Features. Trans Vis Sci Tech. el 5 de septiembre de 2024;13(9):12.
- Li Z, Guo X, Xiao O, Lee PY, Liu R, Wang D, et al. Optic Disc Features in Highly Myopic Eyes: The ZOC-BHVI High Myopia Cohort Study. Optom Vis Sci. abril de 2018;95(4):318–22.
- Chang RT, Singh K. Myopia and glaucoma: diagnostic and therapeutic challenges. Current Opinion in Ophthalmology. marzo de 2013;24(2):96–101.
- Lin F, Chen S, Song Y, Li F, Wang W, Zhao Z, et al. Classification of Visual Field Abnormalities in Highly Myopic Eyes without Pathologic Change. Ophthalmology. julio de 2022;129(7):803–12.
- Agbato D, Rickford K, Laroche D. Central Corneal Thickness and Glaucoma Risk: The Importance of Corneal Pachymetry in Screening Adults Over 50 and Glaucoma Suspects. OPTH. el 15 de febrero de 2025;19:563–70.
- Browning AC. The effect of corneal thickness on intraocular pressure measurement in patients with corneal pathology. British Journal of Ophthalmology. el 1 de noviembre de 2004;88(11):1395–9.
- Chansangpetch S, Panpruk R, Manassakorn A, Tantisevi V, Rojanapongpun P, Hurst CP, et al. Impact of Myopia on Corneal Biomechanics in Glaucoma and Nonglaucoma Patients. Invest Ophthalmol Vis Sci. el 4 de octubre de 2017;58(12):4990.













