Dra. Krishna Pradeep Nayar, Dr. Luis A. Acaba-Berrocal, Dr. Yoshihiro Yonekawa, Dr. Allen C. Ho.
Perspectiva sobre las terapias de próxima generación que están comenzando a aparecer.
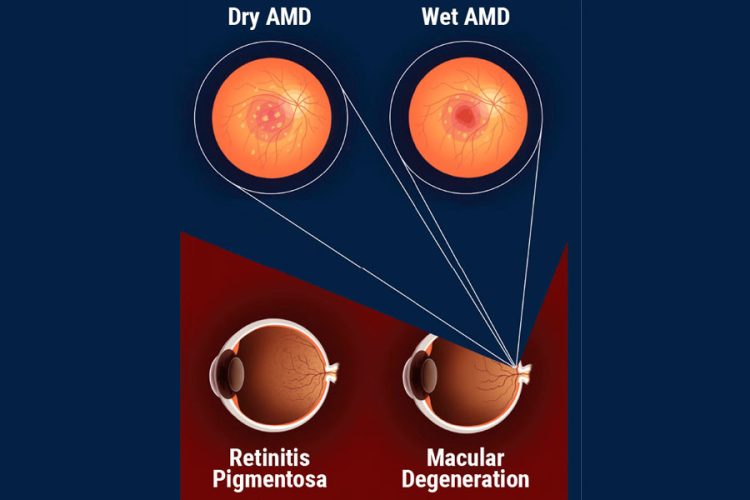
Dicen que el tiempo lo cura todo; sin embargo, quizás, un argumento más preciso sería que el tiempo nos da los datos para sanar todo. Hace veinte años, los pacientes diagnosticados con degeneración macular asociada a la edad tenían pocas opciones de tratamiento. Con el despegue de los estudios AREDS, el tratamiento para la DMAE neovascular se habría limitado a la terapia fotodinámica o la fotocoagulación con láser. Con el tiempo, nuevos actores entraron en el juego cambiando rápidamente el paradigma del campo de la retina y nuestra comprensión sobre la DMAE. El éxito en los ensayos clínicos ayudó a que los medicamentos anti-VEGF, como bevacizumab, ranibizumab y aflibercept se convirtieran en los pilares del tratamiento de la DMAE neovascular.1-3 Hoy en día tenemos incluso opciones para pacientes con DMAE seca avanzada: el pegcetacoplan y el avacincaptad pegol llegan al mercado tras los resultados positivos de los ensayos.4 Sin embargo, los tratamientos actuales requieren el cumplimiento de ventanas de tratamiento estrictas, están asociados con complicaciones potenciales, como la endoftalmitis y la vasculitis retiniana, y no tienen el potencial de restaurar el daño celular ya causado por la enfermedad. Esta es la brecha que las terapias regenerativas esperan llenar.
La terapia celular, si se demuestra como una forma viable de tratamiento, podría ayudar a aliviar algunas de las limitaciones asociadas con nuestro estándar actual de atención en oftalmología. En este artículo, describiremos el desarrollo de ensayos con células madre, con la esperanza de avanzar no solo respecto a la DMAE, sino también acerca de las distrofias retinianas, incluida la retinosis pigmentaria y la enfermedad de Stargardt. A diferencia de la terapia de reemplazo génico, en la que se reemplazan genes específicos para afecciones genéticas específicas, la terapia celular es independiente de la enfermedad. Esto significa que la terapia celular puede ser capaz de proporcionar tratamiento para múltiples enfermedades, independientemente de la composición genética o incluso de la entidad de la enfermedad.
Ensayos Astellas/ACT para la distrofia macular de Stargardt
La distrofia macular de Stargardt (SMD) es la forma más común de distrofia macular juvenil; actualmente, no hay tratamiento aprobado por la FDA en el mercado. Puede estar vinculada a mutaciones del gen ABCA4, causando la desregulación del ciclo retinoide del fotorreceptor, que finalmente conduce a la muerte gradual del EPR y de las células fotorreceptoras.5 Los ojos con SMD avanzada suelen tener visión limitada debido a la atrofia macular.
Las células madre embrionarias, dada su capacidad para diferenciarse en varios tipos de células, tienen un potencial teórico para reparar y reemplazar tejidos degenerados.6 En 2010, la FDA aprobó el segundo ensayo clínico estadounidense para probar células madre embrionarias humanas (hESCs), y fue el primer país en usarlas en pacientes con SMD.7 Ahora adquirido por Astellas Pharma, el estudio 7316-CL-0001 fue iniciado por Advanced Cell Technology (ACT) como una evaluación de seguridad y tolerabilidad de Fase I/II, para el uso de células de EPR derivadas de hESC (llamadas ASP7316 o MA09-hRPE) en pacientes con SMD.8
Se utilizó un diseño idéntico en ensayos simultáneos de SMD basados en el Reino Unido, bajo el protocolo 7316-CL-0003.9 El estudio estadounidense incluyó a 13 pacientes, divididos en cuatro cohortes de “peor visión” y una cohorte de “mejor visión”, basadas en la agudeza visual en el momento de la presentación. A cada cohorte se le asignó una dosis que oscilaba entre 50.000 y 200.000 células hESC RPE, con el mismo diseño replicado para el protocolo británico, 7316-CL-0003, en el que se inscribieron un total de 12 pacientes. Cada paciente se sometió a una vitrectomía pars plana en el ojo con peor visión, seguida de una inyección subretiniana de hESC-RPEs viable en forma de suspensión. Se introdujo un régimen de tacrolimo y micofenolato mofetilo unos días antes de la cirugía para evitar el rechazo. Los pacientes fueron seguidos en el transcurso de 52 semanas después del trasplante de células en los protocolos iniciales estadounidenses y británico, y todos continuaron en los respectivos estudios de seguimiento a largo plazo, de cinco años.
A los seis meses de seguimiento en el ensayo estadounidense, tres pacientes tuvieron una ganancia ≥15 letras de agudeza visual mejor corregida por ETDRS, cuatro mantuvieron la agudeza inicial y un paciente tuvo una disminución ≥10 letras.10 Al año, cuatro pacientes experimentaron una mejora ≥10 letras, mientras que ningún otro ojo no tratado experimentó una ganancia ≥10 letras. En general, el trasplante fue exitoso, sin fracaso ni rechazo, en los 13 pacientes, durante el período de seguimiento de un año. La complicación postoperatoria más prevalente fue una progresión significativa de catarata, como se observó en tres de los 13 pacientes del ensayo estadounidense (dos de los cuales requirieron cirugía de catarata). También se observaron dos casos de inflamación vítrea en este ensayo: uno se atribuyó a una endoftalmitis y el otro se mantuvo estable hasta la resolución espontánea en el sexto mes.10,11
Los datos del estudio LTFU estadounidense, protocolo 7317-CL-0004, mostraron que el tratamiento fue seguro y bien tolerado en todas las dosis, sin eventos de seguridad importantes que respaldaran tendencias dependientes de la dosis. No se observaron respuestas inmunitarias o eventos adversos que indicaran el rechazo ni el malogro del injerto celular, y los datos de agudeza visual demostraron una disminución más aguda en la puntuación de letras de la AVMC para los ojos no tratados en comparación con los ojos tratados hasta el final del estudio. Al cumplirse un año del trasplante, los ojos tratados en el estudio inicial tuvieron una disminución media en la AVMC de 6,7 letras en comparación con una disminución media de 1,3 letra en los ojos no tratados. Sin embargo, a los cinco años posteriores al trasplante, los ojos tratados experimentaron una disminución media de 8 letras en la puntuación de la AVMC, en comparación con 20.7 letras en los ojos que no fueron tratados.12, 13
Los datos del estudio LTFU, del protocolo británico 7316-CL-0006, tampoco informaron evidencia de malogro ni rechazo del injerto, en ninguno de los pacientes. En particular, tampoco hubo una diferencia notable en la AVMC entre los ojos tratados y los no tratados. Entre los 12 pacientes inscritos, el cambio medio en la puntuación de letras de la AVMC para ojos tratados entre la visita inicial y la evaluación posterior al trasplante, al mes 60, fue de 2,8 letras, en comparación con un cambio medio de 2 letras en los ojos no tratados. Se observó con mayor frecuencia la formación de la membrana epirretiniana en los ojos tratados, aunque el número de casos observados para cada ojo aún no se ha publicado.14,15 Si bien aún no se han divulgado los datos sobre la tasa de desprendimientos de retina para estos ensayos, debe tenerse en cuenta que este es un factor de riesgo adicional a considerar para muchos procedimientos transvítreos invasivos, incluidos PPVs y la administración de terapias subretinianas.
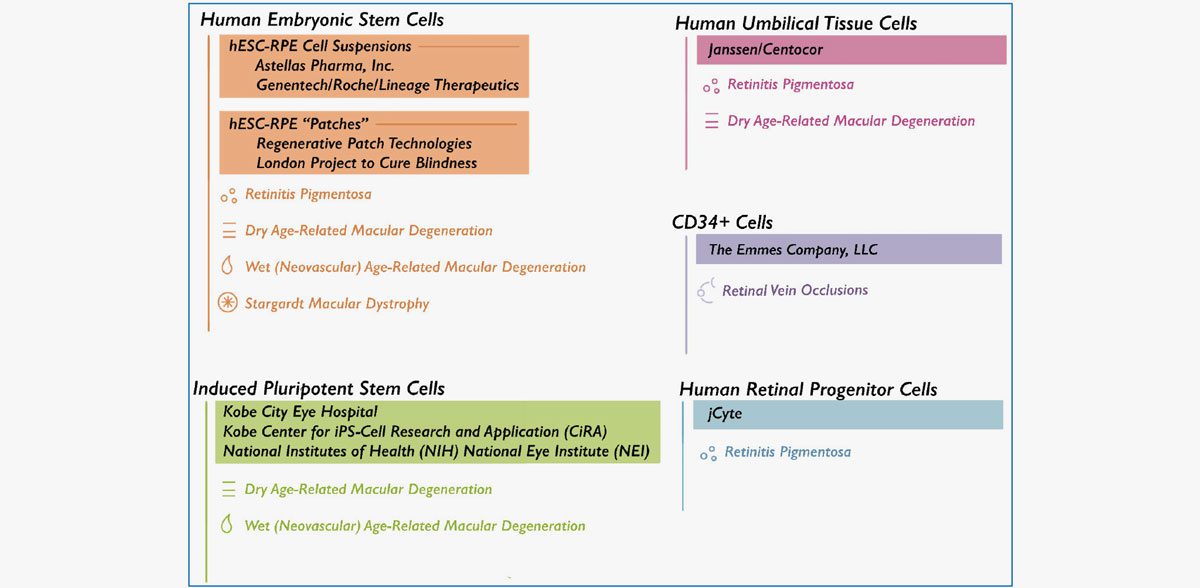
Lista de empresas que investigan terapias celulares para diversas enfermedades de la retina.
Ensayos Astellas para GA secundaria a DMAE
La degeneración de los fotorreceptores y del RPE con pérdida de la visión central es el sello distintivo de la atrofia geográfica (GA) en la DMAE. A principios de la década de 2010, se inició un protocolo de terapia celular para este subconjunto de pacientes para determinar si la línea Astellas ASP7316 de hESC-RPEs podría ser una consideración de tratamiento segura y tolerable para el futuro. El ensayo de seguridad y tolerabilidad de fase I/II, de la línea celular ASP7316 para pacientes estadounidenses con DMAE seca, se realizó bajo el protocolo 7316-CL-0002.16 Un total de 13 pacientes fueron tratados en este estudio que siguió el diseño dosis escalonadas a partir de un trasplante de 50.000 células, que aumentaba en secuencias de 50.000 células por cohorte hasta alcanzar el máximo de 200.000 células. Al igual que en los estudios de SMD, las células se trasplantaron en el espacio subretiniano después de la VPP en el ojo que presentaba peor visión. Al finalizar el ensayo inicial, 11 sujetos se inscribieron en el protocolo LFTU correspondiente de cinco años, 7316-CL-0005, para una revisión adicional.17
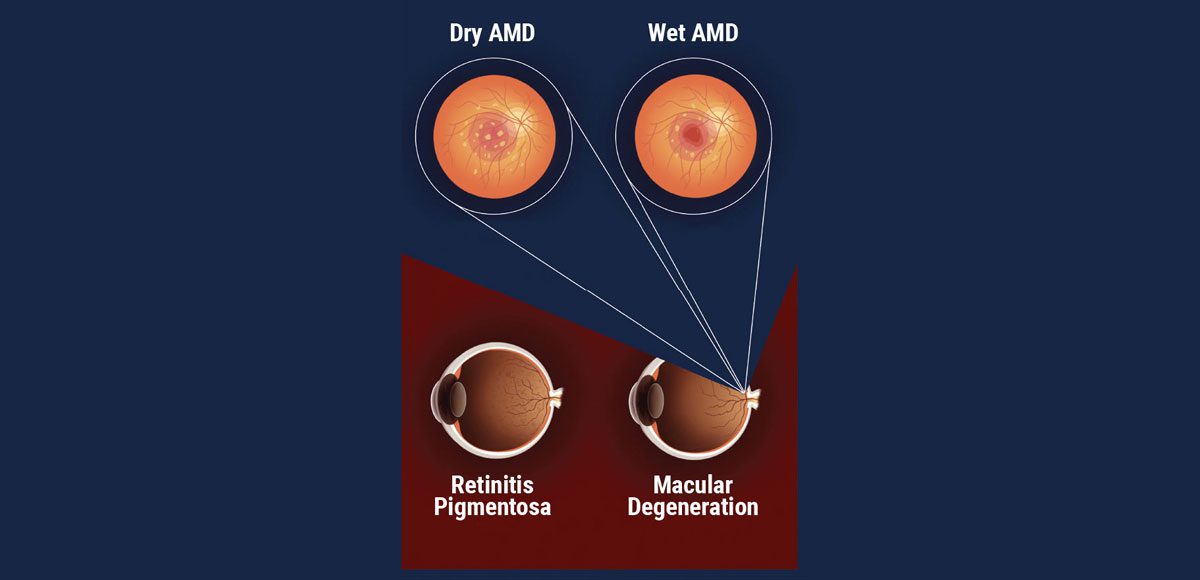
Enfermedades retinianas comunes estudiadas para el uso de terapia celular.
Aunque el análisis de los datos del estudio de seguimiento aún no ha sido publicado, un informe resumido publicado por Astellas indicó que, en general, fue bien tolerado, sin signos de malogro del injerto, respuesta inmunitaria ni rechazo. Al igual que con los estudios iniciales de SMD, todavía no se han publicado datos que indiquen la frecuencia de las complicaciones postoperatorias comunes, como las RDs y la formación de ERM; sin embargo, aún deben tenerse en cuenta como un riesgo potencial para cualquier paciente. Los datos de visión demostraron que entre los meses 12 y 24 del postop, la puntuación media de la AVMC aumentó 10,4 letras en el ojo tratado y 3,8 letras en el ojo no tratado. Sin embargo, al mes 30 del postop, las puntuaciones de letras de la AVMC bajaron 1,6 y 0,7 letra en los ojos tratados y no tratados, respectivamente.18 Un informe de seguimiento analizó esas tendencias de AVMC y comunicó mejores medias para los sujetos que no experimentaron formación de cataratas postoperatorias.10
Dado el éxito en seguridad y tolerabilidad de los ensayos anteriores, la cartera de Astellas ahora incluye un producto actualizado de células hESC-RPE (ASP7317), que continuará siendo investigado como un posible tratamiento para GA y SMD. El ensayo de fase Ib 7317-CL-0003 está inscribiendo/reclutando a pacientes de manera activa recopilando datos de seguridad y tolerabilidad, así como resultados de eficacia relacionados con posibles impactos en la visión y el tamaño de la lesión de GA.19 Se espera que el ensayo esté concluido a finales de 2025, con su diseño siguiendo el del método anterior – de aumento de dosis, de 50.000 a 200.000 células, para tratar a los pacientes. Al igual que con los protocolos anteriores de Astellas, este procedimiento quirúrgico incluye VPP seguido de inyección subretiniana de la dosis celular designada para cada paciente en función de la selección de la cohorte.
Ensayos de Roche/Genentech (anteriormente CellCure/Lineage) para GA
En 2015, Lineage Cell Therapeutics comenzó un ensayo de dosis escalonadas de Fase I/IIa que probaba una suspensión celular de células hESC-RPE directamente diferenciadas (RG6501) en pacientes con GA en ambos ojos secundaria a DMAE seca. De manera similar a la terapia celular utilizada en todo el proceso de Astellas, el ensayo Lineage investigó las células hESC-RPE para determinar la seguridad y la tolerabilidad administradas en dos formas: la primera, una implantación subretiniana estándar trás VPP y la segunda, la administración de células desde el espacio supracoroideo hasta el subretinal (Orbit Subretinal Delivery System), aprobada por la FDA, que se realizó en siete de los 24 pacientes inscritos. Un total de 12 pacientes fueron tratados con dosis de RG6501, entre 50.000 y 150.000 células, mientras que los 12 pacientes restantes recibieron 200.000 unidades de células.20,21
La primera fase del ensayo siguió a los sujetos hasta un año después del trasplante; 21 sujetos han continuado en la segunda fase, que fue un periodo de seguimiento rutinario por hasta cinco años. Este estudio todavía está recopilando datos activamente como parte de su segmento de seguimiento. Los criterios de valoración incluyen el análisis de la seguridad y la tolerabilidad, así como cambios en la tasa de progresión de la GA. A los sujetos se les asignó tratamiento con tacrolimo y micofenolato durante seis y 12 semanas después del trasplante, respectivamente.22
En general, los datos demostraron que los hESC-RPEs fueron bien tolerados por la mayoría de los pacientes, aunque dos de los 17 pacientes del grupo de la PPV experimentaron RDs tras el trasplante, y 15 de los 17 pacientes del grupo experimentaron una formación de ERM de leve a moderada. Ambos desprendimientos de retina observados se trataron y resolvieron posteriormente; de los 15 casos de ERM, tres requirieron pelado quirúrgico. Entre los siete pacientes tratados con RG6501 mediante suministro supracoroideo, se observó neovascularización coroidea en tres casos, uno de los cuales se resolvió completamente después de un solo tratamiento con anti-VEGF. Los dos pacientes restantes con NVC requirieron la administración regular de anti-VEGF después del inicio de AE.21
En términos de cambios visuales y progresión de la enfermedad a lo largo del tiempo, las cohortes de dosis más bajas siguieron un curso relativamente típico de progresión de GA desde la cirugía hasta el seguimiento a largo plazo, sin que se revelaran resultados notables en los resultados provisionales.
El grupo de 200.000 células, sin embargo, mostró resultados más prometedores, particularmente en la lesión de GA más pequeña y mejor cohorte de AV inicial, y cuando la ampolla subretiniana mostró un amplia cobertura de la lesión GA. De los 12 pacientes inscritos en esa cohorte, tres (el 25%) tuvieron una mejoría en la AVMC (Agudeza visual mejor corregida) ≥15 letras en el ojo tratado, en el primer año después del trasplante. El cambio promedio en la AVMC en el primer año después del trasplante fue una ganancia de 7,6 letras. Sin embargo, los ojos no tratados bajaron, en promedio, su puntuación de letras de la AVMC.
De manera similar, las imágenes de autofluorescencia de fondo de ojo mostraron que los ojos tratados en todas las cohortes demostraron tasas reducidas de pérdida de RPE en el borde de las lesiones de GA.23,24 Los sujetos con un amplia cobertura de ampolla demostraron mejoras en la estructura externa de la retina en el análisis cualitativo por OCT realizado por un calificador enmascarado. Se espera la conclusión del ensayo de fase I/IIa, actualmente en fase observacional, a mediados de 2025.
Otro estudio de fase IIa, RG6501 GA, de Roche y Genentech, el protocolo GR44251, está actualmente activo e inscribe a cerca de 60 pacientes en California, Ohio y Pensilvania.25,26 A diferencia del estudio inicial de dosis escalonadas, este ensayo se centra solo en los resultados de seguridad y eficacia de la dosis de 200.000 células hESC-RPE, con la esperanza de proporcionar más potencia estadística a los datos en los resultados de la cohorte de dosis alta del ensayo de fase I/IIa Lineage.
Ensayos de tecnologías de parches regenerativos para GA
Un estudio de 2016 realizado por Regenerative Patch Technologies (RPT) exploró el uso de un implante de “parche” retiniano de bioingeniería para GA, que consiste en una monocapa de células de RPE maduras derivadas de hESC adheridas a una estructura de perileno.27
El producto celular (CPCB-RPE1) se administró por vía subretiniana a 16 pacientes inscritos en este ensayo de fase I/IIa, cubriéndoles completamente la lesión atrófica en cada ojo del estudio. Se administró tacrolimo y esteroides intravenosos a todos los sujetos.
El método quirúrgico para este estudio fue publicado en 2020 por el Dr. Amir Kashani, PhD, et al., del Roski Eye Institute, de la University of Southern California.28 Cabe destacar que esta implantación monocapa requirió una hidrodisección subretiniana de la lesión GA, lo que resultó en un tiempo quirúrgico promedio más largo en comparación con los ensayos, que utilizaron una suspensión de hESC-RPE. Esta técnica podría reducir el porcentaje de células que refluyen hacia el vítreo en comparación con las inyecciones de células subretinianas con células de RPE que están todas alineadas en la orientación correcta. En general, el 86.9% del área basal de la GA fue cubierto por el implante monocapa, en todos los participantes del estudio.
En 15 de los 16 pacientes que recibieron el implante exitoso de CPCB-RPE1 en el espacio subretiniano, el método de administración monocapa de RPE se consideró factible para pacientes con GA.28 Las hemorragias retinianas se observaron con frecuencia durante todo el estudio; sin embargo, en su mayoría fueron transitorias después del procedimiento quirúrgico. Durante tres años de seguimiento postoperatorio, los ojos tratados tuvieron más probabilidades de experimentar un aumento >5 letras de AVMC que los ojos no tratados, los cuales tenían una mayor probabilidad de reducir >5 letras de AVMC.29 Se espera que el próximo ensayo de fase IIb sea el siguiente en desarrollo, para proporcionar más datos sobre la seguridad y la eficacia potencial del implante de bioingeniería.
Ensayos de Janssen/Centocor para retinosis pigmentaria y DMAE
La investigación sobre terapia celular tiene un alcance más amplio, que va más allá de las hESCs. Los ensayos de Janssen/Centocor han intentado determinar la eficacia e inmunogenicidad de las células RPE derivadas del tejido umbilical humano (hUTC-RPEs; denominadas Palucorcel o CNTO 2476) para enfermedades degenerativas de la retina.
A diferencia de las hESCs, estas células se derivan de células madre adultas multipotentes, lo que significa que son capaces de diferenciarse en diferentes tipos de células que pueden promover la reparación de los tejidos dañados.30 Probado clínicamente por primera vez en 2007, el ensayo de fase I CNTO 2476, de Centocor, estaba dirigido a pacientes con retinosis pigmentaria, un grupo de trastornos genéticos que causan la degeneración de los fotorreceptores y pérdida gradual de la visión.31 Después de inscribir y tratar a siete pacientes, el ensayo fue concluido a principios de 2013, debido al desenvolvimiento de desprendimiento de retina (RD) en dos sujetos. Esta tasa de RD se atribuyó principalmente al método del manejo quirúrgico utilizado en el ensayo, que fue el manejo transvítreo de la línea celular en el espacio subretiniano. Se consideró el tratamiento en sí (CNTO 2476) como “posiblemente relacionado” con los RDs. Además, este ensayo hUTC no utilizó terapias inmunosupresoras, y un estudio histológico más detallado de una membrana epirretiniana muestreada de uno de los casos de RD en el ensayo no pudo confirmar la seguridad inmunológica de CNTO 2476.32
Una vez adquirida por Janssen Research & Development, se inició un estudio de fase I/IIa, en el año 2010, para probar la seguridad, tolerabilidad y eficacia de la línea CNTO 2476 en pacientes con GA.
Se administró el CNTO 2476 a 33 pacientes inscritos en el ensayo CR017548, y aunque no se observaron casos de respuesta inmunitaria ni rechazo, el alta tasa de RDs y desgarros de retina observados (17,1% y 37,1%, respectivamente) enfatizó la necesidad de más modificaciones en el enfoque quirúrgico. Sin embargo, los datos de ganancia visual para los ojos tratados en este estudio fueron optimistas: el 24,1% de los ojos mantuvieron una ganancia ≥15 letras al año postoperatorio, y el 34,5% mostraron una mejora ≥10 letras en el mismo período de tiempo.33
El estudio PRELUDE de Janssen siguió en 2015 y se llevó a cabo con la esperanza de que un abordaje desde el espacio supracoroideo hasta el subretiniano pudiera reducir el riesgo de las complicaciones observadas en los ensayos anteriores.34
En este ensayo de fase IIb, 21 pacientes recibieron una administración de aproximadamente 300.000 hUTC-RPEs del supracoroideo al subretiniano a través de un enfoque quirúrgico actualizado, que utilizó un sistema de administración personalizado para la suspensión celular. Si bien los eventos adversos con el nuevo enfoque quirúrgico fueron menos extremos y la utilidad del sistema de administración personalizada demostró ser exitosa, los datos sobre la visión y la progresión de la GA resultaron confusos y no señalaron ningún beneficio aparente con el tratamiento con hUTC-RPE.35 El sistema de administración evolucionó hasta convertirse en el Orbit Subretinal Delivery System, aprobado por la FDA.
Ensayos de Kobe en láminas de iPSC-RPE y organoides de retina
Además de las hUTC, la seguridad y la eficacia de los tratamientos con células madre pluripotentes inducidas (iPSC) para las enfermedades de la retina también han representado un área de gran interés. En 2017, un estudio del Centro Kobe, en Japón, para la Investigación y Aplicación de Células iPS (CiRA, por sus siglas en inglés) evaluó la viabilidad de las células de RPE autólogas derivadas de iPSC en dos pacientes con DMAE húmeda.36
A diferencia de las células alogénicas, como las hESCs, la terapia celular autóloga deriva células madre valiosas y diferenciables de los propios pacientes, lo que reduce el riesgo de rechazo del trasplante y proporciona un método de recolección de células más fácil.37
Dos pacientes se inscribieron en este estudio, en el que las iPSCs se elaboraron a partir de sus propios fibroblastos de la piel, y luego se prepararon con éxito en láminas de RPE ex vivo. Solo un paciente fue tratado con la lámina autóloga iPSC-RPE, debido a las deleciones génicas detectadas en el segundo paciente que presentaban riesgos imprevistos. En el paciente tratado, la extirpación de la membrana neovascular se realizó antes del trasplante subretiniano de la lámina de RPE. Un año tras el trasplante, no se observaron signos de rechazo del injerto, malogro ni eventos adversos graves, y la presencia de células RPE pareció crecer con el tiempo en las imágenes de OCT. La sensibilidad retiniana y la agudeza visual se mantuvieron estables en el ojo tratado en 20/200, durante todo el período de estudio del seguimiento.
Recientemente, el grupo Kobe City Eye Hospital publicó un informe tras el primer ensayo clínico con láminas de organoides retinianos derivados de iPSC.38 Como se describe, los organoides de retina pueden ser más prometedores que las suspensiones o “parches” de células madre, debido a su capacidad de representar algo más que la pérdida de EPR en las enfermedades degenerativas de la retina.
Los primeros modelos animales demuestran el potencial de estos organoides para ayudar a restaurar una mayor función visual debido a su capacidad para diferenciarse en fotorreceptores viables, lo que explica el deterioro de los fotorreceptores que se produce en la enfermedad avanzada.
Se realizó el implante subretiniano de tres láminas de organoides en dos pacientes con RP avanzada. Se indujeron intencionalmente desprendimientos de retina superficiales en el ojo elegido, y la implantación se localizó en sitios que enseñaban retención de RPE para maximizar la oportunidad de conexiones sinápticas con la retina del huésped. Se utilizó aceite de silicona como taponamiento, mientras que se proporcionó triamcinolona intravítrea y ciclosporina oral para suprimir una posible inflamación.
No se informaron casos de inflamación intraocular, rechazo del injerto ni eventos adversos sistémicos graves durante los dos años de seguimiento. Si bien los criterios de valoración exploratorios no mostraron cambios significativos en los resultados del funcionamiento visual en ninguno de los pacientes, el tratamiento fue bien tolerado en ambos casos.
El futuro de la investigación celular
La investigación sobre terapia celular continúa ampliando el alcance de su uso en oftalmología y más allá. En 2018, un ensayo de fase I, en el que se investigó un parche de hESC-RPEs, proporcionó resultados optimistas después de tratar a dos pacientes con DMAE húmeda grave.39 Un estudio de un solo centro en California está aplicando estas nuevas tecnologías a las oclusiones de venas de la retina probando la seguridad y la viabilidad de las células madre CD34 en un ensayo de Fase I/II, en el que inscribió a 16 pacientes siguiendo los datos de la Fase I.40,41
También se están estudiando más de cerca las células progenitoras de la retina humana (hRPCs) por su potencial para reactivar fotorreceptores en pacientes con retinosis pigmentaria. Los resultados recientes de un ensayo de seguridad de fase II realizado por jCyte demostraron la seguridad de las inyecciones intravítreas de hRPC para RP en 30 pacientes, y se prevé que siga un ensayo de fase II/III más grande a finales de 2024.42 Entidades como Astellas y NIH también planean seguir con el desarrollo de iPSC para los trastornos de la retina, debido a su eficiencia, escalabilidad y potencial para el tratamiento.43,44
En conclusión, hay un gran potencial para las terapias celulares como opción de tratamiento para una miríada de enfermedades y degeneraciones de la retina. Aunque hasta la fecha ha habido pocos ensayos de terapia celular en la retina, han surgido datos prometedores sobre seguridad y tolerabilidad, incluso en intervalos de largo plazo. Los ensayos actuales de terapia celular continúan basándose en estudios anteriores, y esperamos que este campo de investigación en rápido crecimiento nos ofrezca conocimiento sobre cómo pueden cambiar nuestros enfoques de tratamiento en un futuro próximo.
La Sra. Nayar era la coordinadora principal de investigación clínica en el departamento de Investigación de Retina del Wills Eye Hospital/Mid Atlantic Retina, en el momento de escribir este artículo. Ahora es investigadora clínica asociada.
El Dr. Acaba-Berrocal es residente de PGY4 en el Illinois Eye and Ear Infirmary , University of Illinois-Chicago. Enfermería de Ojos y Oídos de Illinois, en la Universidad de Illinois-Chicago.
El Dr. Yonekawa es profesor asociado de oftalmología en el Wills Eye Hospital/Mid Atlantic Retina/Thomas Jefferson University. Es cirujano vitreorretiniano para adulto y pediátria.
El Dr. Ho es profesor de oftalmología de la Universidad Thomas Jefferson. Es cirujano vitreorretiniano y director de Investigación de Retina en el Wills Eye Hospital/Mid Atlantic Retina, en Filadelfia.