(Este artículo fue traducido, adaptado e impreso con autorización exclusiva del grupo de revistas de Review de Jobson Medical Information. Su reproducción está prohibida).
El Dr. Zein es investigador de córnea en Bascom Palmer y en el McKnight Vision Research Center. Tiene maestría en Ciencias de la Visión y Oftalmología Investigativa.
El Sr. Djulbegovic es candidato a doctor en medicina en la University of Miami Miller School of Medicine. Tiene Maestría en Bioinformática y Biología Computacional.
El Dr. Galor es profesor de oftalmología en Bascom Palmer y médico de planta en el Miami VAMC.
La Dra. Teira es ecografista oftálmico sénior en el Servicio de Oncología Ocular de Bascom Palmer y especialista en retina.
La Dra. Karp es profesor de oftalmología, en la Cátedra Richard K. Forster en Oftalmología y la Cátedra Dotada por el Dr. Ronald & Alicia Lepke en Enfermedades de la Córnea y la Superficie Ocular en el Bascom Palmer Eye Institute, en la University of Miami Miller School of Medicine.
Los autores declaran no tener ningún conflicto de interés.
Expertos evalúan las mejores modalidades de imagen para valorar lesiones sospechosas.
Los tumores de la superficie ocular y el segmento anterior del ojo pueden ser el resultado de una amplia gama de condiciones. Las lesiones benignas o malignas pueden tener su origen en varios tipos de células formando lesiones epiteliales, melanocíticas, linfoides, fibrosas y muchas otras.1Es importante determinar la etiología y el potencial maligno de una lesión para obtener un diagnóstico y una guía de tratamiento adecuados. La biopsia de tejido es el estándar de oro para establecer un diagnóstico, pero se han desarrollado modalidades basadas en imágenes que pueden ayudar al médico a evaluar estos tumores antes de la confirmación histopatológica.
Las cuatro modalidades más utilizadas son: tomografía de coherencia óptica de segmento anterior de alta resolución (HR-OCT), angiografía OCT, biomicroscopía ultrasónica y microscopía confocal in vivo (IVCM).1-3 Si bien es útil, cada tecnología tiene fortalezas y debilidades que deben tenerse en cuenta al examinar las lesiones de la superficie ocular. Aquí, destacaremos los pros y los contras y discutiremos cómo se pueden incorporar estas tecnologías en la evaluación de un paciente con tumor de la superficie ocular.
AS-OCT de alta resolución
La tomografía de coherencia óptica del segmento anterior proporciona imágenes transversales de alta resolución del tejido del segmento anterior a través de la dispersión óptica creada por interferometría de baja coherencia.4 Desde su primera iteración por David Huang, MD, PhD, y colegas, la tecnología HR-OCT ha progresado a resoluciones de 5 a 10 µm y profundidades de escaneo de 2 a 7 mm. La OCT de segmento anterior de ultra alta resolución proporciona una resolución aún mayor, de 2 a 5 µm.5-7
- Ventajas. En la práctica oftálmica actual, la HR-OCT proporciona una modalidad de diagnóstico no invasiva en el consultorio con resultados fácilmente disponibles, lo que permite una «biopsia óptica» que a menudo refleja los cambios patológicos observados en la histopatología.5,7,8 Esto es útil en la toma de decisiones clínicas. Por ejemplo, en una lesión con características clínicas y OCT clásicas de neoplasia escamosa de la superficie ocular (OSSN), se puede iniciar el tratamiento con quimioterapia tópica. En una lesión con características de melanoma, el cirujano debe posponer una biopsia por incisión y, en cambio, planificar un tratamiento con una biopsia por escisión con márgenes amplios y crioterapia adyuvante.
La OCT anterior es más útil para diferenciar las lesiones epiteliales de las subepiteliales. Por ejemplo, al evaluar una lesión conjuntival pigmentada, la detección de un epitelio hiperreflectivo engrosado, con una transición abrupta de un epitelio normal a anormal, apunta hacia un diagnóstico de OSSN pigmentado en contraposición a un melanoma conjuntival (CM).8 En cambio, el médico puede identificar que una lesión conjuntival no pigmentada con un epitelio delgado y una lesión que se observa debajo del epitelio probablemente no sea una OSSN y, si hay una masa subepitelial hiperreflectiva, puede ser un melanoma amelanótico.
Además, las imágenes de HR-OCT pueden detectar o descartar la presencia de tumores, particularmente OSSN, en ojos con comorbilidades, como deficiencia de células madre del limbo o antecedentes de queratitis herpética.9 La HR-OCT también puede ayudar al médico a monitorear la respuesta al tratamiento, ya que puede detectar enfermedades subclínicas. Esto ayuda a evitar la terminación anticipada de la quimioterapia tópica.2La HR-OCT también se ha utilizado preoperatoriamente para mejorar la visualización del tumor y proporcionar un plano antes de la escisión quirúrgica y la localización directa de la biopsia.10 Afortunadamente, existe una breve curva de aprendizaje para interpretar imágenes. Incluso los usuarios principiantes pueden identificar correctamente una variedad de lesiones de la superficie ocular con una sensibilidad moderada y una alta especificidad.1, 11
- Desventajas. La HR-OCT puede limitarse sombreando lesiones gruesas, queratinizadas o pigmentadas. Como tal, las características y la profundidad de estas lesiones son difíciles de evaluar.12 Además, la HR-OCT no puede examinar el tejido a nivel celular y, por lo tanto, no puede identificar la atipia celular o la invasión a estructuras más profundas. La primera limita su capacidad para distinguir la metaplasia escamosa de la OSSN, la melanosis asociada a la tez (CAM) de la melanosis adquirida primaria (PAM) y el linfoma conjuntival de la hiperplasia linfoide reactiva benigna (BRLH). Si bien a veces en el carcinoma de células escamosas se visualiza una conexión con la masa subepitelial subyacente, la capacidad de evaluar la invasión no es confiable.12-14 En última instancia, se necesita tejido para examinar estructuras a nivel celular y distinguir entre estas entidades.2,15
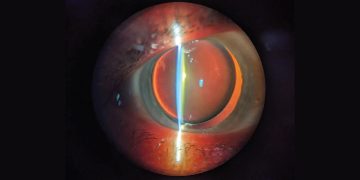
- Hallazgos de imagen. Numerosos tumores que surgen en la superficie ocular tienen características distintivas en la HR-OCT. La OSSN se caracteriza por un epitelio engrosado e hiperreflectivo con una transición abrupta entre el epitelio normal y el anormal (Figura 1).16 Utilizando un aparato de OCT de ultra alta resolución hecho a medida, con 2-3 µm de resolución, encontramos que un espesor epitelial de más de 142 µm distinguía la OSSN del pterigión con una sensibilidad del 94% y una especificidad del 100%.17,18 Estudios adicionales de nuestro grupo con una HR-OCT disponible comercialmente (RTVue, Optovue, Fremont, California) mostraron una sensibilidad y especificidad del 100% con un límite de espesor epitelial de 120 µm para diferenciar OSSN y pterigión.14Más recientemente, se demostró que otro dispositivo disponible comercialmente (Spectralis SD-OCT, Heidelberg Engineering, Heidelberg, Alemania) puede demostrar una sensibilidad y especificidad del 100% para distinguir OSSN de pterigión, con un límite de 141 µm.18
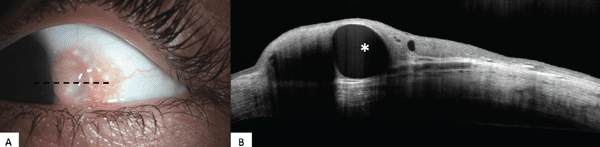
Las lesiones melanocíticas también tienen varias características distintivas en la HR-OCT. Los quistes intralesionales son una característica útil que apunta hacia un nevo conjuntival (Figura 2). Además, la hiperreflectividad del epitelio basal es una característica compartida por la CAM conjuntival y la PAM.14, 19 Una característica diferenciadora de los nevos es la falta de quistes observados en CAM y PAM.12-14 La CM en la HR-OCT generalmente tiene un epitelio hiperreflectivo uniforme y delgado y, similar a PAM, carece de quistes. A diferencia de PAM, la CM tiene una masa hiperreflectiva subepitelial y una mayor intensidad de sombreado posterior (Figura 2C).14, 20 El linfoma conjuntival aparece como una lesión subepitelial homóloga, hiporreflectiva rodeada por una banda de tejido hiperreflectiva superior a la masa. El BRLH parece similar al linfoma conjuntival, pero tiene una apariencia más granular, con pequeños puntos punteados hiperreflectantes dentro de la masa.14, 21
Angiografía OCT
La OCT-A recopila de forma no invasiva numerosas exploraciones en una amplia gama de ángulos para crear una imagen tridimensional de la anatomía, la vasculatura y el flujo sanguíneo del segmento anterior.2, 22-26 La OCT-A se diseñó originalmente para evaluar la patología de la retina; requiere una lente adaptadora para obtener imágenes del segmento anterior y los tumores que pueden surgir en el iris, la córnea, la conjuntiva y la esclerótica.26, 27
- Ventajas. La OCT-A es una tecnología relativamente reciente con el primer informe de OCT-A utilizado en el segmento anterior en 2015.28Como herramienta no invasiva para la obtención de imágenes de tejido vascular, tiene la ventaja de no presentar efectos secundarios o reacciones secundarias a los colorantes inyectados utilizados en la angiografía tradicional.29,30La OCT-A también puede detectar ciertas características de OSSN que no se pueden detectar clínicamente o con la HR-OCT, sobre todo los patrones de vascularización dentro, adyacentes y debajo del tumor.31
- Desventajas. Una limitación de la OCT-A es que produce imágenes con artefactos que pueden limitar la interpretación de la imagen. Los tipos de artefactos más frecuentes están asociados con el movimiento ocular, las proyecciones y la señal OCT baja.22-24 La frecuencia y gravedad de los artefactos, como los artefactos de segmentación, pueden depender del dispositivo de la OCT-A utilizado, mientras que otros, como el movimiento ocular, pueden depender de factores del paciente (p. Ej., movimientos oculares excesivos en un paciente con parkinsonismo).24El conocimiento de los posibles artefactos es clave para interpretar las imágenes de la OCT-A. Se espera que el software futuro y el escaneo más rápido mejoren algunos de estos problemas.
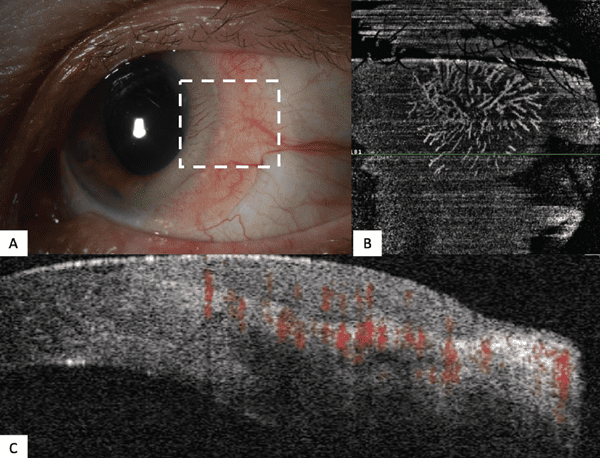
- Hallazgos de imagen. En comparación con la HR-OCT, la literatura sobre los hallazgos de tumores de la superficie ocular con OCT-A es limitada. Sin embargo, una serie de casos que comparó los hallazgos de OCT-A en dos lesiones OSSN versus una lesión de pterigión describió un «patrón de vaso en zigzag» en OSSN en comparación con un «patrón de vaso recto» en el pterigión.31 Un estudio utilizó la OCT-A para determinar la densidad total del tumor (porcentaje de vasos sanguíneos dentro de todo el tumor) y la densidad del área de los vasos, VAD, (porcentaje de vasos sanguíneos dentro de 2,14 mm2) en el tumor, el tejido circundante y el ojo contralateral).32 Se encontró que el VAD era más alto dentro de los tumores conjuntivales, seguido por el tejido subepitelial adyacente a los tumores y luego por el tejido 200 µm por debajo del tumor. Otro grupo examinó las características de las lesiones melanocíticas en la OCT-A y notificó más tortuosidad de los vasos en la CM en comparación con la PAM y los nevos conjuntivales.33 Si bien estas características no se han utilizado para diagnosticar una lesión, proporcionan hallazgos adyuvantes que no siempre son evidentes clínicamente.
El uso de la OCTA en los tumores de la superficie ocular aún se encuentra en sus inicios, y todavía no está claro cómo la detección de los vasos ayudará con el diagnóstico y el seguimiento.8, 21, 24,26 No obstante, proporciona imágenes muy detalladas que no son clínicamente evidentes, pero que actualmente ayudan a aclarar la fisiopatología de la tumorigénesis (Figura 3).
Biomicroscopía de ultrasonido
La biomicroscopia de ultrasonido (UBM) aplica ondas de ultrasonido de alta frecuencia al tejido biológico, como el segmento anterior, para obtener una imagen de corte transversal.1-3,34 Las mediciones cuantitativas de A-scan (lesiones> 2 mm) y de B-scan estandarizadas relacionadas con la anatomía y patología de la conjuntiva, la córnea, el ángulo iridocorneal, el iris, las zónulas, el cuerpo ciliar y el cristalino se pueden obtener utilizando UBM .34 Se pueden utilizar ondas de ultrasonido de 25 MHz y 50 MHz para examinar la superficie ocular. Las frecuencias más altas (50 MHz) proporcionan una mejor resolución de la anatomía desde la cámara anterior hasta el área capsular, y las frecuencias más bajas (25 MHz) proporcionan una resolución más baja, pero campos de visión más amplios y profundos de las estructuras que abarcan la córnea hasta el área retrocapsular.1-3,34
- Ventajas. El beneficio principal de la UBM es su capacidad para penetrar tumores opacos y superar parcialmente el sombreado posterior, que comúnmente afecta la HR-OCT. También proporciona imágenes de alta resolución de lesiones densas y gruesas.1-3 La UBM ha demostrado ser superior a la HR-OCT en términos de visualización de los márgenes tumorales. En una serie de casos de 200 tumores del segmento anterior la UBM demostró una leve superioridad en identificar el margen anterior (90% contra el 82%) y una superioridad significativa en identificar el margen posterior (90% contra el 29%) de la lesión.35 Debido a su capacidad para sondear con eficacia lesiones grandes, la UBM es una herramienta excelente para evaluar la invasión intraocular oculta y la metástasis que pueden presentarse como embotamiento del ángulo de la cámara anterior y engrosamiento uveal.2,3 Con respecto a los tumores melanocíticos que a menudo son gruesos y pigmentados, la UBM a menudo puede obtener imágenes del margen profundo.1,2 En este sentido, la UBM tiene potencial como herramienta no invasiva para estimar el grosor del tumor antes de la intervención quirúrgica. Una pequeña serie de casos demostró la concordancia relativa (diferencia de 0 a 0,5 mm de espesor) comparada con el espesor de Breslow.36
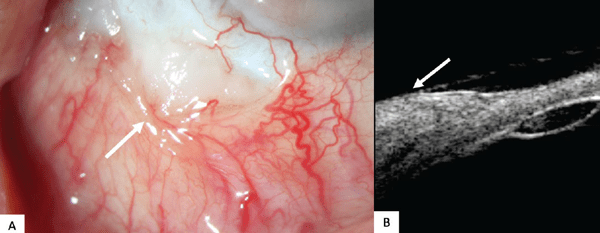
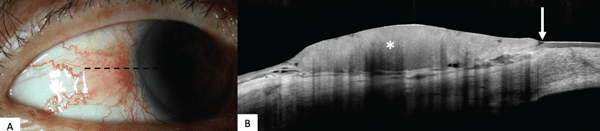
- Desventajas. Si bien la UBM a menudo puede delimitar los márgenes y la extensión de los tumores grandes, no ofrece vistas de alta resolución de los aspectos interiores de la lesión y, a menudo, no puede visualizar bien los tumores delgados.1 Tampoco puede diferenciar entre diferentes tumores, como lo hace la HR-OCT (Figura 4). Además, la UBM, a diferencia de la HR-OCT y OCT-A, requiere un baño ocular en una posición reclinada y contacto con el tejido, y el aparato requiere una mayor familiaridad técnica.1-3 El acceso a la UBM generalmente se limita a los grandes centros terciarios.
Microscopía confocal In Vivo
- Hallazgos de imagen. En la UBM, el componente estromal y la extensión intraocular de los tumores (si está presente) tienen ecogenicidad variable.2, 37 Esto es cierto para una variedad de tumores y, como tal, no se han descrito hallazgos intralesionales específicos y únicos que distingan la OSSN de la CM.35 Además, hay una falta de literatura que describa las características del linfoma conjuntival en UBM. Sin embargo, los linfomas intraoculares se han descrito como hipoecoicos en las cámaras anterior y posterior del ojo.38Se necesitan estudios futuros para delinear mejor las características ecoicas internas de los tumores conjuntivales en UBM.
La microscopía confocal in vivo es una herramienta de imagen que permite el análisis morfológico y cuantitativo del tejido de la superficie ocular a nivel microscópico y celular con un aumento de hasta 800x y una resolución impresionante.39 Las iteraciones actuales de la IVCM citan resoluciones de 4 µm (axial) y 2 µm (lateral).40 Desde la década de 1990, la IVCM ha surgido como una herramienta de diagnóstico útil en el repertorio de especialistas en córnea.41
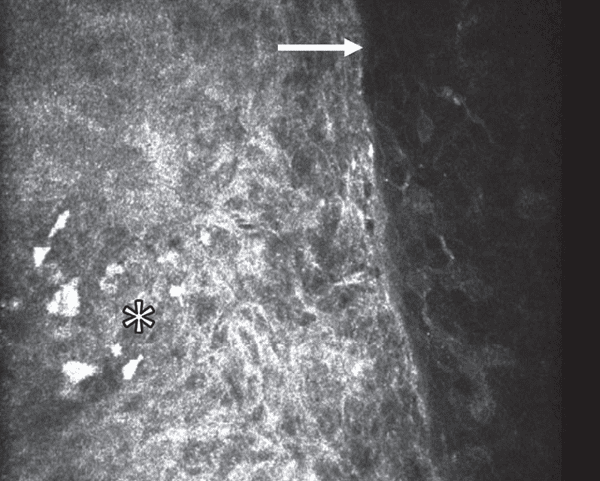
- Ventajas. La IVCM también se ha utilizado para examinar las características celulares de la OSSN. Las características incluyen capas anterior y media de epitelio que contienen células escamosas pleomórficas hiperreflectivas, estroma superficial cargado de figuras mitóticas nucleares y una clara transición entre el epitelio normal y neoplásico y las células pleomórficas.42 Además, la IVCM se ha utilizado para evaluar la respuesta celular a la quimioterapia tópica en la OSSN con detección de reflectividad de células epiteliales reducida, una transición menos definida entre tejido normal y anormal ,y fragmentación de grupos de células anormales (Figura 5).42 También se ha demostrado que la IVCM diferencia entre PAM con y sin atipia. Las características diferenciadoras incluyen una gran red de células dendríticas y gránulos hiperreflectivos en todas las capas del epitelio en PAM con atipia, y células dendríticas más pequeñas y gránulos hiperreflectivos limitados al epitelio basal en PAM sin atipia.43,44 La IVCM no ha demostrado diferenciar las lesiones linfomatosas de las inflamatorias con hallazgos similares de células redondas pequeñas altamente reflectantes dispuestas de manera difusa en el epitelio y subepitelio en ambos.1,43
- Desventajas. La IVCM tiene varios factores que limitan su uso en la evaluación de las lesiones de la superficie ocular. Una limitación es su pequeño campo de visión que representa solo una pequeña porción de la lesión en un plano en cada punto. Además, el software actualmente disponible no ha podido definir puntos de referencia que puedan ayudar al médico a determinar qué parte de la lesión se está obteniendo imágenes. Además, los estudios han demostrado que tanto las lesiones malignas como las benignas pueden tener cambios celulares; debido a esto, la IVCM no se puede utilizar de forma aislada para diagnosticar una lesión en particular.2, 43 Los detalles a nivel celular también se oscurecen en las lesiones con un componente hiperqueratinizado.45, 46 Al igual que la UBM, se requiere el contacto con los tejidos, así como la experiencia técnica para capturar las imágenes e interpretarlas.
- Hallazgos de imagen. Varios estudios han intentado caracterizar los tumores de la superficie ocular utilizando la IVCM. Se han descrito varias características de la OSSN en la IVCM. Un estudio describió las células displásicas con figuras mitóticas nucleares y nidos de células de vórtice en las capas superficiales del estroma.47Otro estudio informó células pleomórficas hiperreflectivas y una ausencia de nervios corneales subbasales en el epitelio afectado por la OSSN. Finalmente, un tercer estudio describió que la OSSN tiene una apariencia de “cielo estrellado” con núcleos agrandados, irregulares e hipercromáticos con puntos brillantes en la célula basal.42 Sin embargo, también se encontró que lesiones benignas como pterigión, pinguécula y papiloma contenían irregularidades celulares similares, con una serie de casos de 60 pacientes que demostraron una sensibilidad y especificidad del 38,5% y el 66,7%, respectivamente, al comparar la OSSN con las lesiones conjuntivales benignas.48
También se ha descrito la aparición de lesiones pigmentadas en la IVCM. Los nevos conjuntivales exhibieron colecciones de células estromales uniformes de tamaño mediano junto con estructuras similares a pseudoquiste. La PAM con atipia presenta células dendríticas grandes y células hiperreflectivas en todo el epitelio, mientras que la PAM sin atipia tiene células dendríticas más pequeñas y células hiperreflectivas limitadas al epitelio basal. La CM tiene células grandes con núcleos y nucléolos prominentes con invasión indicada por hiperreflectividad en las capas subepiteliales.44 Las características del linfoma conjuntival en la IVCM incluyen un epitelio normal y células hiperreflectivas pequeñas, abundantes y compactas en un espacio similar a un quiste, que se correlacionan con los linfocitos en el tejido estromal.43, 49
En conclusión, el arsenal de modalidades de diagnóstico por imagen a disposición del oncólogo de la superficie ocular es numeroso y versátil en sus fortalezas y debilidades. Los cuatro se han utilizado, en diversas situaciones, como complementos para el diagnóstico, el manejo y el seguimiento de pacientes con tumores de la superficie ocular, y todos pueden ayudar a los médicos a examinar las lesiones en una medida mucho mayor de lo que es posible con la lámpara de hendidura sola.
REFERENCIAS:
- Nanji AA, et al. Updates in ocular surface tumor diagnostics. Int Ophthalmol Clin 2017; 57:3:47-62.
- Venkateswaran N, Sripawadkul W, Karp CL, The role of imaging technologies for ocular surface tumors. Curr Opin Ophthalmol 2021; 32:4: 369-378.
- Ong SS, Vora GK, Gupta PK. Anterior segment imaging in ocular surface squamous neoplasia. J Ophthalmol 2016; 2016:5435092 [Epub].
- Izatt JA, et al. Micrometer-scale resolution imaging of the anterior eye in vivo with optical coherence tomography. Arch Ophthalmol 1994;112:12:1584-9.
- Ang M, et al. Anterior segment optical coherence tomography. Prog Retin Eye Res 2018;66:132-156.
- Venkateswaran N, et al. High resolution anterior segment optical coherence tomography of ocular surface lesions: A review and handbook. Expert Review of Ophthalmology 2021;16:2:81-95.
- Huang D, et al. Optical coherence tomography. Science 1991;254:5035:1178-81.
- Thomas BJ, et al. Ultra high-resolution anterior segment optical coherence tomography in the diagnosis and management of ocular surface squamous neoplasia. Ocul Surf 2014;12:1:46-58.
- Atallah M, et al. Role of high resolution optical coherence tomography in diagnosing ocular surface squamous neoplasia with coexisting ocular surface diseases. The Ocul Surf 2017;15:4:688-695.
- Karp CL, et al. Use of high-resolution optical coherence tomography in the surgical management of ocular surface squamous neoplasia: A pilot study. Am J Ophthalmol 2019;206:17-31.
- Yim M, et al. Ability of novice clinicians to interpret high-resolution optical coherence tomography for ocular surface lesions. Can J Ophthalmol 2018;53:2:150-154.
- Shousha MA, et al. Diagnosis of ocular surface lesions using ultra-high-resolution optical coherence tomography. Ophthalmology 2013;120:5:883-91.
- Alzahrani YA, et al. Primary acquired melanosis: Clinical, histopathologic and optical coherence tomographic correlation. Ocul Oncol Pathol 2016;2:3:123-7.
- Nanji AA, et al. High-resolution optical coherence tomography as an adjunctive tool in the diagnosis of corneal and conjunctival pathology. Ocul Surf 2015;13:3:226-35.
- Tanenbaum RE, et al. Classification, diagnosis, and management of conjunctival lymphoma. Eye and Vision 2019;6:1:22.
- Venkateswaran N, et al. Optical coherence tomography for ocular surface and corneal diseases: A review. Eye Vis (Lond) 2018;5:13.
- Kieval JZ, et al. Ultra-high resolution optical coherence tomography for differentiation of ocular surface squamous neoplasia and pterygia. Ophthalmology 2012;119:3:481-6.
- Lozano García I, et al. High resolution anterior segment optical coherence tomography for differential diagnosis between corneo-conjunctival intraepithelial neoplasia and pterygium. Arch Soc Esp Oftalmol (Engl Ed) 2020;95:3:108-113.
- Shields CL, et al. Anterior segment optical coherence tomography of conjunctival nevus. Ophthalmology 2011;118:5:915-9.
- Koç İ, Kıratlı H. Current management of conjunctival melanoma part 1: Clinical features, diagnosis and histopathology. Turk J Ophthalmol 2020;50:5:293-303.
- Venkateswaran N, et al. The use of high resolution anterior segment optical coherence tomography for the characterization of conjunctival lymphoma, conjunctival amyloidosis and benign reactive lymphoid hyperplasia. Eye Vis (Lond);2019:6:17.
- de Carlo TE, et al. A review of optical coherence tomography angiography (OCTA). Int J Retina Vitreous 2015.1:5.
- Pichi F, Roberts, Neri. The broad spectrum of application of optical coherence tomography angiography to the anterior segment of the eye in inflammatory conditions: A review of the literature. J Ophthalmic Inflamm Infect 2019;91:18.
- Anvari P, et al. Artifacts in optical coherence tomography angiography. J Ophthalmic Vis Res 2021;162:271-286.
- Siddiqui Y, Yin J. Anterior segment applications of optical coherence tomography angiography. Semin Ophthalmol 2019;34:4:264-269.
- Lee WD, et al. Optical coherence tomography angiography for the anterior segment. Eye Vis (Lond) 2019;6:4.
- Tan ACS, et al. An overview of the clinical applications of optical coherence tomography angiography. Eye (Lond) 2018;32:2:262-286.
- Ang M, et al. Optical coherence tomography angiography for anterior segment vasculature imaging. Ophthalmology 2015;122:9:1740-7.
- López-Sáez MP, et al. Fluorescein-induced allergic reaction. Ann Allergy Asthma Immunol 1998;81:5:428-30.
- Hope-Ross M, et al. Adverse reactions due to indocyanine green. Ophthalmology 1994;101:3:529-33.
- Nampei K, et al. Comparison of ocular surface squamous neoplasia and pterygium using anterior segment optical coherence tomography angiography. Am J Ophthalmol Case Rep 2020; 20:100902.
- Liu Z, et al. Role of optical coherence tomography angiography in the characterization of vascular network patterns of ocular surface squamous neoplasia. Ocul Surf 2020;18:4:926-935.
- Brouwer NJ, et al. Anterior segment octa of melanocytic lesions of the conjunctiva and iris. Am J Ophthalmol 2021;222:137-147.
- Martin R. Cornea and anterior eye assessment with slit lamp biomicroscopy, specular microscopy, confocal microscopy, and ultrasound biomicroscopy. Indian J Ophthalmol 2018;66:2:195-201.
- Bianciotto C, et al. Assessment of anterior segment tumors with ultrasound biomicroscopy versus anterior segment optical coherence tomography in 200 cases. Ophthalmol 2011;1187:1297-302.
- Ho VH, et al. Ultrasound biomicroscopy for estimation of tumor thickness for conjunctival melanoma. J Clin Ultrasound 2007;35:9:533-537.
- Finger PT, et al. High-frequency ultrasonographic evaluation of conjunctival intraepithelial neoplasia and squamous cell carcinoma. Arch of Ophthalmol 2003;121:2:168-172.
- Pavlin CJ, Harasiewicz K, Foster FS. Ultrasound biomicroscopy of anterior segment structures in normal and glaucomatous eyes. Am J Ophthalmol 1992;113:4:381-389.
- Cruzat A, Qazi Y, Hamrah. In vivo confocal microscopy of corneal nerves in health and disease. Ocul Surf 2017;15:1:15-47.
- Bille JF, ed. High Resolution Imaging in Microscopy and Ophthalmology: New Frontiers in Biomedical Optics. Cham: Springer, 2019.
- Cavanagh HD, et al. Confocal microscopy of the living eye. CLAO J 1990;16:1:65-73.
- Zarei-Ghanavati M, et al. Changes in in vivo confocal microscopic findings of ocular surface squamous neoplasia during treatment with topical interferon alfa-2b. Ocul Surf 2018;16:2:235-241.
- Cinotti E, et al. Handheld reflectance confocal microscopy for the diagnosis of conjunctival tumors. Am J Ophthalmol 2015;159:2:324-33.e1.
- Messmer EM, et al. In vivo confocal microscopy of pigmented conjunctival tumors. Graefes Arch Clin Exp Ophthalmol 2006;244:11:1437-45.
- Parrozzani R, et al. In vivo confocal microscopy of ocular surface squamous neoplasia. Eye (Lond) 2011;25:4:455-60.
- Xu Y, et al. The clinical value of in vivo confocal microscopy for diagnosis of ocular surface squamous neoplasia. Eye (Lond) 2012;26:6:781-7.
- Liang QF, et al. Histopathology manifestation and imaging characteristics of in vivo confocal microscopy for diagnosis of ocular surface squamous neoplasia. Zhonghua Yan Ke Za Zhi 2018;54:9:652-660.
- Nguena MB, et al. Diagnosing ocular surface squamous neoplasia in East Africa: Case-control study of clinical and in vivo confocal microscopy assessment. Ophthalmology 2014;121:2:484-91.
- Pichierri P, et al. In vivo confocal microscopy in a patient with conjunctival lymphoma. Clin Exp Ophthalmol 2008;36:1:67-9.