Dr. Javier Mendicute
España
jmendicu@chdo.osakidetza.net
Jefe de servicio, servicio de oftalmología,
Hospital Universitario Donostia
Director médico, Innova Begitek Clínica Oftalmológica
Donostia/San Sebastián, España
Introducción
La cirugía del cristalino en ojos pequeños es un reto al que nos enfrentarnos a diario en nuestra práctica clínica. Siendo la catarata la indicación más frecuente, la lensectomía en estos casos ha adquirido enorme relevancia como la mejor opción refractiva. Pero sus beneficios no son solo refractivos, también ofrece la posibilidad de un mejor control tensional en glaucomas de ángulo estrecho o como prevención para el desarrollo de glaucomas agudos en ojos anatómicamente predispuestos, tal y como ha sido sugerido por el estudio EAGLE.
Como hemos mencionado, la lensectomía es la solución refractiva que proporciona corrección bilateral y permanente para la corrección de la hipermetropía y la presbicia. Pero en la toma de decisiones se hace imprescindible valorar la edad, el grado de opacidad cristaliniana, la asociación de defectos refractivos, la dinámica pupilar, el riesgo de cierre angular y las necesidades y preferencias del paciente.
La valoración preoperatoria, la biometría y las fórmulas, la cirugía y el riesgo de complicaciones intraoperatorias, la selección de lentes intraoculares y el manejo posoperatorio, en estos casos, es diferente a la cirugía de cristalino en ojos de longitudes axiales normales. Y en estos aspectos nos centraremos en estas líneas.
Clasificación
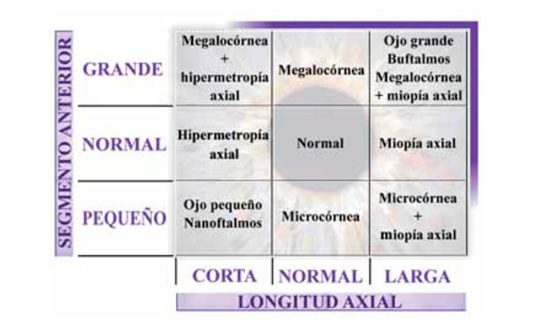
Longitud axial y cámara anterior. Combinaciones posibles.
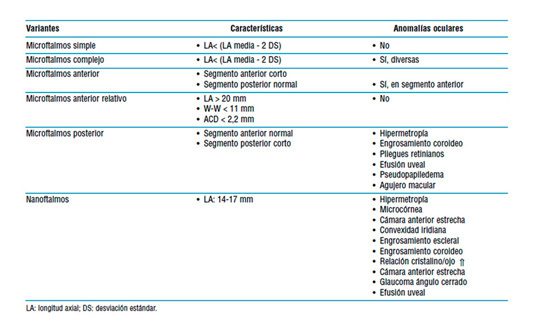
Con los mencionados parámetros es necesario establecer una clasificación. Microftalmos, microftalmos anterior relativo, microftalmos No existe una definición clara y definitiva de lo que entendemos por ojo corto (short/small eye, en la literatura anglosajona). En general, se acepta como ojo corto aquel que presente una longitud axial inferior a 22,5 mm. Pero la clasificación no es tan sencilla. Es necesario considerar longitud axial (AL), diámetro corneal (WW) y profundidad de cámara anterior (ACD), así como la posible coexistencia de patología asociada. Un ojo, independientemente de su longitud axial (corta, normal, larga), puede tener un segmento anterior pequeño, normal o grande, dando lugar a diferentes entidades clínicas. Posterior y nanoftalmos, entre otros, son las posibles formas de presentación de un ojo corto.
Ojos cortos. Formas clínicas
Desde un punto de vista quirúrgico, los ojos con segmentos anteriores pequeños pueden dificultar la cirugía, requiriendo el conocimiento de ciertos principios quirúrgicos, pero algunos ojos cortos (microftalmos complejo, microftalmos posterior y, especialmente, el nanoftalmos), pueden presentar alteraciones del segmento posterior tipo engrosamiento coroideo o efusión uveal, pudiendo comprometer la recuperación funcional tras la cirugía. Si demandamos prudencia en el ojo nanoftálmico en el que si existiera engrosamiento esclero-coroideo deberíamos tomar medidas preventivas específicas. Las mismas consideraciones merecen la coexistencia de glaucoma, debilidad zonular u otra patología. En cualquier caso, quien aborde la cirugía de catarata en un ojo corto debe conocer previamente las alteraciones estructurales que existan, en un caso concreto, las posibles complicaciones que pueden surgir durante la cirugía y la forma de solucionarlas.
Exploración preoperatoria, biometría y fórmulas
En ojos cortos es necesario extremar la cantidad y calidad de las medidas preoperatorias, conocer las características biométricas que pueden hacer más compleja la cirugía y asegurar las medidas que puedan mejorar el cálculo de la potencia de la lente intraocular a implantar.
Son imprescindibles: 1) Queratometrías; 2) Diámetro corneal; 3) Paquimetría; 4) Profundidad de cámara anterior; 5) Medida del ángulo camerular; 6) Espesor cristaliniano; 7) Grosor esclero-coroideo; y 8) Profundidad de cavidad vítrea.
Es necesario reconocer que muchos ojos cortos presentan un ángulo de cámara anterior con riesgo de bloqueo. Y esto es necesario tenerlo en cuenta. La exploración del segmento anterior en lámpara de hendidura aporta una valoración de la profundidad de cámara anterior en relación con el espesor corneal, como fue sugerido por Van Heryck, que puede ser útil. Sin embargo, la OCT de segmento anterior puede dar medidas más objetivas; así, la profundidad, el área y el volumen cámara anterior, el grosor, curvatura y área del iris, y el vault de cara anterior del cristalino, son determinantes al condicionar un cierre angular.
Estimación ángulo según Van Herick. El conocer la apertura del ángulo puede anticipar el riesgo de oclusión angular.
Hoy, en mi opinión, la valoración del segmento anterior y la adecuada medida de la longitud axial son claves para lograr el éxito en estos casos. Y el PentacamTM y el IOL MasterTM, o equipos similares, imprescindibles.
El PentacamTM permite medir: 1) Curvatura corneal anterior; 2) Curvatura corneal posterior; 3) Total corneal power y eje; 4) Aberraciones alto orden [RMS]; 5) Aberración esférica; 6) Estudio de topografías atípicas, para descartar patrones ectásicos; 7) Espesor corneal; 8) Estado angular (imagen y grados); 9) Cristalino (posición y densidad); 9) Posición lente intraocular (centrado y tilting); 10) Foto del ojo (para referencias anatómicas para lentes tóricas, por ejemplo); 11) Medida de la longitud axial (con el modelo HR/AXL); y 12) Posibilidad de cálculo de lentes (Modelo HR/AXL).
La llamada biometría óptica, como la practicada con el IOL MasterTM está llamada a sustituir a la biometría ultrasónica en la mayor parte de las cirugías de cataratas y en prácticamente todos los casos de lensectomía refractiva. Sus ventajas: 1) Sencillez de uso; 2) Menor técnico-dependencia en los resultados obtenidos; 3) Rapidez de ejecución; y 4) Alineamiento foveal asegurado. Sus inconvenientes, quedarían limitados a su escasa utilidad ante grandes opacidades de medios o cataratas subcapsulares posteriores.
En nuestra experiencia, la fórmula Holladay II9 que reconoce siete variables para el cálculo de la ELP (longitud axial, queratometría, diámetro corneal horizontal, profundidad de la cámara anterior, grosor del cristalino, refracción preoperatoria y edad), es la que permite una mayor predictibilidad.10 Otros cálculos basados en fórmulas de 4ª generación, ray tracing o inteligencia artificial (RBF-Hill fórmula, por ejemplo) deben aún demostrar su superioridad en la predicción refractiva tras cirugía de cristalino.
Técnicas preparatorias en cirugía de cristalino en ojo corto
Actualmente, la facoemulsificación es la técnica de elección en este tipo de ojos. Con tal técnica, evitamos la descompresión brusca de la cámara anterior, que sucedía con la cirugía intra- y extracapsular, y la hipotonía secundaria, factores que pueden desencadenar complicaciones graves en ojos con cámara anterior estrecha.
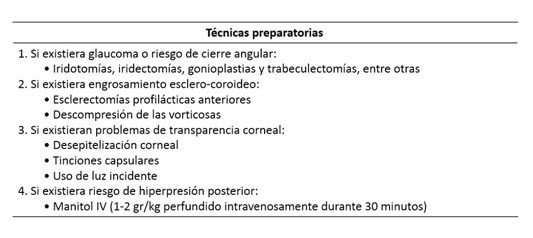
Una cámara anterior muy estrecha puede dificultar la rexis y poner en riesgo la facoemulsificación. Hay glaucomas facomórficos, en general por cataratas intumescentes en ojos cortos, en los que es necesario extraer la catarata para solucionarlos. Un desplazamiento anterior del diafragma irido-cristaliniano-zonular puede ser expresión de debilidad zonular o de una dehiscencia zonular, puede ser causa de un síndrome de mala dirección (aqueous misdirection syndrome) y debe alertarnos sobre la necesidad de requerir una estabilización cristaliniana para practicar la facoemulsificación y para asegurar la estabilidad de la lente intraocular tras la cirugía. En un ojo con un coloboma iridiano puede existir un déficit zonular en la zona del coloboma; en tal caso o ante dehiscencias zonulares puede existir riesgo de paso de fluidos a segmento posterior: colorantes tipo Vision Blue®, que pueden acabar tiñendo el vítreo, o soluciones de irrigación, que pueden provocar un síndrome de mala dirección y agravar el estrechamiento de cámara anterior habitual en estos casos. Hechas las consideraciones previas, existen técnicas preparatorias que pueden ser de ayuda en estos casos.
Ojos cortos. Técnicas preparatorias previas a la lensectomía.
Cirugía de cristalino con cámara anterior estrecha: 10 claves
Pasaremos a describir las 10 claves más relevantes para el éxito en este tipo
de cirugía.
Incisión. Las incisiones en córnea clara y en zona temporal permiten un mejor abordaje en ojos cortos con cámara anterior estrecha. La incisión corneal en estos casos debería ser, especialmente, exquisita en su ejecución y arquitectura; recomendaríamos: 1) En un primer paso, una incisión de 1,6-1,8 mm: tal tamaño de incisión es suficiente como para poder practicar una capsulorrexis y evitar la pérdida excesiva de viscoelástico; posteriormente puede ampliarse al tamaño necesario para la facoemulsificación; 2) Es necesario evitar que la entrada en cámara anterior sea muy próxima a la raíz del iris, por el riesgo de prolapso iridiano; 3) La trayectoria intraestromal de la incisión debe ser suficiente como para disminuir el riesgo de complicaciones: ni corta, que favorecería la hernia de iris, ni larga, que dificultaría la visualización.
Viscoelásticos. En ojos cortos con cámara anterior estrecha existe la tendencia a querer profundizarla con viscoelásticos no siendo infrecuente la hiperpresurización de la misma; si intentamos practicar la incisión principal en tal situación (exceso de viscoelástico en cámara anterior), la tendencia es a favorecer una entrada prematura y a ejecutar un trayecto intraestromal corto, situación que no deseamos. Es un hecho conocido que los viscoelásticos dispersivos mantienen mejor los espacios pero dificultan, en cierto grado, algunas maniobras quirúrgicas como, por ejemplo, la capsulorrexis. Para aprovechar las ventajas de los viscoelásticos dispersivos y cohesivos, Arshinoff describió la técnica en escudo (softshelltechnique) que pretende beneficiarse de las ventajas de ambos tipos de viscoelásticos. Inicialmente se inyecta un viscoelástico dispersivo, que rellena toda la cámara anterior y que contribuye a crear espacios, y posteriormente, sobre la zona central de la cápsula anterior del cristalino, uno cohesivo que facilitará la maniobrabilidad del instrumental en su interior y facilitará la capsulorrexis. Con esta técnica se logra una mayor estabilización del ojo, una menor tendencia al prolapso del iris y una mejor protección endotelial; el mayor inconveniente es que deben introducirse ambos viscoelásticos con dos jeringas diferentes, enlenteciendo el proceso.
Viscoelásticos: pauta de actuación. Recomendaríamos 1) Tras la paracentesis de servicio, y antes de practicar la incisión principal, se asoma la cánula de viscoelástico en cámara anterior a través de ella, o a través de la incisión principal, y se inyecta un pequeño volumen, alejando al iris de la incisión; 2) A continuación, se inyectan pequeños bolos a 45° a izquierda y derecha de la incisión (de esta forma se amplía la cámara anterior y se desplaza el iris contra el cristalino); 3) En un tercer paso, inyectamos otros dos pequeños bolos a 90° de las dos zonas anteriores (de este modo, tenemos cinco zonas en las que el iris es presionado sobre el cristalino y se amplía parcialmente la profundidad de la cámara anterior (así evitamos el acceso del viscoelástico al espacio retroiridiano); y 4) finalmente, se procede a rellenar la cámara anterior, lentamente (permitimos que el escaso humor acuoso que aún pudiera encontrarse ocupando tal espacio salga a través de la incisión).
Viscoelásticos en cámara anterior estrecha. Se va ampliando el espacio con la introducción de pequeñas cantidades de viscoelástico en el ángulo, desde las zonas próximas a la incisión hasta las más alejadas, para, finalmente, rellenar toda la cámara anterior.
Cistitomo con viscoelástico durante la capsulorrexis. En cámaras anteriores estrechas, podemos utilizar el cistitomo conectado a la jeringa de viscoelástico como ha sido sugerido por Teus.13 De esta forma, si perdiéramos cámara durante la capsulorrexis, procederíamos a la inyección de viscoelástico durante el procedimiento.
Vitrectomía vía pars plana. Si al iniciar la cirugía, y a pesar de practicar unas incisiones correctas y del uso racional de viscoelásticos, no lográramos espacio suficiente como para iniciar la capsulorrexis existe una última alternativa quirúrgica preparatoria: una vitrectomía vía pars plana para ampliar la cámara anterior.14 En estos casos no es necesaria una vitrectomía por tres vías; una vitrectomía en seco puede ser suficiente.
Hidrodisección. En ojos con cámara anterior estrecha hay que tener en cuenta que existe un mayor riesgo de desarrollar un síndrome de mala dirección de fluidos (misdirection syndrome) o un bloqueo capsular. Es conveniente drenar levemente el viscoelástico de cámara anterior, presionando el labio de la incisión con la cánula de irrigación de forma previa a la hidrodisección. Hay que practicar una hidrodisección suave controlando la cantidad de fluido que se introduce, observando siempre la punta de la cánula, deprimiendo levemente el núcleo cristaliniano y levantando suavemente la cápsula anterior para lograr una hidrodisección limpia.
Facoemulsificación. En estas situaciones, cámaras anteriores estrechas, debemos practicar la técnica que nos permita un mínimo uso de energía de facoemulsificación con los mínimos gestos quirúrgicos y siempre bajo la máxima protección endotelial. Necesitamos disminuir el tiempo útil de facoemulsificación (dutycycle) y la energía utilizada recurriendo, de forma controlada, a formas pulsadas de administración de energía, bien en modo pulsado o en modo ráfagas (burst) o a formas de facoemulsificación torsional. Siendo conocido que las técnicas de chop presentan ventajas frente a las de fractura o cracking desde el punto de vista del ahorro de energía, menor tiempo quirúrgico y menor manipulación instrumental requerida.15,16 Respecto a las técnicas de chop, en presencia de cámaras anteriores estrechas recomendaríamos la técnica stop & chop, técnica que permite abrir rápidamente un espacio central en el que alojar el tip de facoemulsificación y el chopper, alejándolos así del endotelio y habilitando espacio para las maniobras quirúrgicas.
Prevención del surge. Con cualquiera de las técnicas mencionadas, al ir a finalizar la facoemulsificación del núcleo recomendaríamos bajar los niveles de vacío e interponer la espátula entre la cápsula y el fragmento restante para evitar la rotura capsular por efecto del surge, más probable y de mayor riesgo en estos casos debido a la cámara anterior estrecha (para una misma unidad de volumen aspirada con el surge, en un ojo corto se pierde mayor volumen porcentual en relación con el volumen del segmento anterior que en un ojo largo) y la presión positiva que, más frecuentemente, pueden presentar estos ojos.
Mióticos. En ojos cortos, en los que una catarata ha podido empeorar la tendencia al cierre angular o donde el compromiso de espacio ha podido facilitar el desarrollo de goniosinequias, pensamos que el uso de medicamentos, en administración intracamerular, que faciliten la miosis, como la acetilcolina, puede ser de gran utilidad. Tales medicamentos alejarán la raíz del iris de la incisión, abrirán el ángulo alejando la posibilidad de contacto raíz de iris con córnea y, con ello, la posibilidad de desarrollar goniosinequias por el componente inflamatorio de las primeras horas.
Goniosinequiolisis. Si tras la instilación de mióticos la pupila no regresara a su posición inicial, si la miosis es asimétrica o si, por observación del ángulo se confirmara la presencia de goniosinequias, la goniosinequiolisis (Fig. 6) puede ser útil en la liberación del ángulo si se practica en los primeros 12 meses desde que se desarrollan.
Fig. 6. Goniosinequiolisis. En ojos con cierres angulares previos, la cirugía de catarata es una buena ocasión para liberar las sinequias angulares y facilitar el drenaje de humor acuoso. Es necesario evitar las tracciones excesivas que pudieran provocar sangrado.
Lentes intraoculares
En estos casos, puede existir cierta limitación de disponibilidad de rango dióptrico en ojos especialmente cortos. Lo deseable, hoy, es implantar una lente plegable para seguir manteniendo las ventajas de la incisión pequeña. Y sabemos que las lentes acrílicas hidrófilas e hidrófobas pueden ser fabricadas en ópticas más finas que las de silicona, debido a su mayor índice de refracción, y que pueden ser implantadas a través de incisiones de menor tamaño y de forma mucho más controlada. En ojos cortos, las lentes acrílicas hidrófobas presentan ventajas respecto a otro tipo de lentes debido a su menor espesor central y su implantación más controlada. Otras ventajas, respecto a otros materiales, referidas a su biocompatibilidad, menor posibilidad de adherencia bacteriana y deterioro ante agresiones externas,17 además de su menor tasa de opacificación y contracción de cápsula anterior18,19 así como de opacificación de cápsula posterior20 son también ventajas a no desdeñar en ninguna circunstancia.
Láser femtosegundo
La cirugía de cristalino en cámaras anteriores estrechas es una de las circunstancias en las que el láser femtosegundo es claramente superior a la facoemulsificación no asistida por tal tecnología. Una capsulorrexis independiente de la profundidad de cámara anterior y una prefragmentación del cristalino son dos premisas que nos facilitarán la cirugía de catarata, incluso en circunstancias extremas.
(Video 2: https://youtu.be/fTzbjsS2xqQ Ojo con preparación con femtosegundo y cámara anterior estrecha que precisa fenilefrina intracamerular antes de completar la facoemulsificación).
Conclusiones
En ojos cortos es imprescindible asegurar que no existe otra patología ocular asociada (microftalmos, nanoftalmos o microftalmos anterior relativo) en base a la exploración preoperatoria. También, preoperatoriamente es necesario practicar un mayor número de exploraciones si queremos clasificar morfológicamente el ojo a intervenir y utilizar fórmulas de cálculo de última generación.
Es imprescindible conocer la situación refractiva del ojo contralateral para plantearnos el objetivo refractivo deseado y siempre es necesario considerar cuál va a ser la actitud, quirúrgica o no, sobre el ojo contralateral, tenga o no catarata. La cirugía es más exigente y debe asegurar la protección endotelial y para ello es útil el uso racional de los viscoelásticos y el practicar técnicas que ahorren el uso de energía.
Respecto a la lente, lo ideal sería una lente asférica, implantada intrasacularmente, dado que el riesgo de desarrollar aberraciones con lentes de elevada potencia dióptrica es mayor. De no existir rango dióptrico en este tipo de lentes, no queda más remedio que implantar una lente esférica de elevada potencia, aunque la calidad visual pueda verse comprometida. Y la cirugía de cristalino en ojos cortos, añade a las ventajas refractivas la posibilidad de mejorar el componente angular y eliminar el riesgo de desarrollar un glaucoma con componente angular. Y en el ojo corto es donde el láser femtosegundo puede ofrecer sus mayores ventajas.
Referencias
Síganos DS, Pallikaris IG. Clear lensectomy and intraocular lens implantationfor hyperopia from +7 to +14 diopters. J RefractSurg 1998;14:105-113.
Azuara-Blanco A, Burr J, Ramsay C, et al; EAGLE studygroup. Effectiveness of early lens extraction for the treatment of primary angle-closure glaucoma (EAGLE): a randomised controlled trial. Lancet 2016;388(10052):1389-1397. doi: 10.1016/S0140-6736(16)30956-4.
Van Herick W, Shaffer RN, Schwartz A. Estimation of width of angle of anterior chamber. Incidence and significance of the narrow angle. Am J Ophthalmol 1969;68:626-629.
Nongpiur ME, Sakata LM, Friedman DS, et al. Novel association of smaller anterior chamber width with angle closure in Singaporeans. Ophthalmology 2010;117:1967-1973.
Wu RY, Nongpiur ME, He MG, et al. Association of narrow angles with anterior chamber area and volume measured with anterior segment optical coherence tomography. Arch Ophthalmol 2011;129:569-574.
Wang BS, Sakata LM, Friedman DS, et al. Quantitative iris parameters and association with narrow angles. Ophthalmology 2010;117:11-17.
Nongpiur ME, He MG, Amerasinghe N, et al. Lens vault, thickness and position in Chinese subjects with angle closure. Ophthalmology 2011;118:474-479.
Tan GS, He M, Zhao W, et al. Determinants of lens vault and association with narrow angles in patients from Singapore. Am J Ophthalmol 2012;154:39-46.
Holladay JT. Advanced IOL powercalculations. ASCRS meeting. Boston, 1997.
Mendicute J, Aramberri J, Illarramendi I. Predictability and visual outcome with clear lensectomy and Holladay II for hyperopia. Presentado en: 6th ESCRS Winter Refractive Surgery Meeting. Barcelona, 2002.
Arshinoff SA, Wong E. Understanding, retaining, and removing dispersive and pseudodispersive ophthalmic viscosurgical devices. J Cataract Refract Surg 2003;29:2318-2323.
Arshinoff SA. Dispersive-cohesive viscoelastic soft shell technique. J Cataract Refract Surg 1999;25:167-173.
Teus M, Fagundez-Vargas MA, Calvo MA, Marcos A. Viscoelastic injecting cystotome. J Cataract Refract Surg 1998;24:1432-1433.
Chang D. Pars plana vitreous tap for phacoemusification in the crowded eye. J Cataract Refract Surg 2001;27:1911-1914.
Ram J, Wesendahl TA, Auffarth GU, Apple DJ. Evaluation of in situ fracture versus chop techniques. J Cataract Refract Surg 1998;24:1464-1468.
Wong T, Hingorani M, Lee V. Phacoemulsification time and power requirements in phacochop and divide and conquer nucleo fractis techniques. J Cataract Refract Surg 2000;26:1374-1378.
Alava JI, Garagorri N, Briz N, Mendicute J. Effects of bacterial adhesión with respect to the type of material, structure and designs of intraocular lens. J Mater Sci Mater Med 2005;16:313-317.
Werner L, Pandey SK, Apple DJ, Escobar-Gómez M, McLendon L, Macky TA. Anterior capsule opacification: correlation of pathologic finding swith clinical sequelae. Ophthalmology 2001;108:1675-1681.
Werner L, Pandey SK, Escobar-Gomez M, Visessook N, Peng Q, Apple DJ. Anterior capsule opacification: a histopathological study comparing different IOL styles. Ophthalmology 2000;107:463-471.
Auffarth GU, Brezin A, Caporossi A, Lafuma A, Mendicute J, Berdeaux G, Smith AF; European PCO Study Group. Ophthalmic Epidemiol 2004;11:319-329.