Por Sam S. Dahr, MD
Por Sam S. Dahr, MD
En cualquiera de los principales encuentros sobre la retina, las sesiones acerca de la uveítis suelen centrarse en casos de diagnóstico interesantes, a menudo lo hacen en infecciones o síndromes de enmascaramiento. Sin embargo, en la práctica de cada día, la mayoría de los casos que el especialista de la retina encuentra serán de origen no infeccioso e idiopático. Por consiguiente, el desafío no es tanto el diagnóstico, sino la ejecución de una estrategia terapéutica adecuada a lo largo de un período de tiempo medido en años.
La uveítis no infecciosa afecta aproximadamente a 300.000 adultos y 22.000 niños estadounidenses (Tabla 1).1 Muchos de estos pacientes son jóvenes, y un tratamiento insuficiente al principio, en el curso de la enfermedad, puede conducir a un deficiente resultado visual que será una carga durante décadas. En este artículo, presento una simple pero poderosa estrategia terapéutica que un especialista de la retina, aunque no posea una beca en uveítis, pueda utilizar.
| Tabla 1. Predominio de la uveitis no infecciosa | ||
| Por 100.000 | Adultos | Niños |
| Predominio general | 121 (117-124.3) | 29 (26.1-33.2) |
| Anterior | 98 (94.7-100.9) | 22 (19.3-25.4) |
| Intermedia | 1 (0.8-1.5) | 0 (0.1-1.1) |
| Posterior | 10 (9.4-11.5) | 3 (1.8-4.1) |
| Panuveitis | 12 (10.6-¡@.7) | 4 (2.9-5.6) |
Consideraciones de diagnóstico
Las pruebas de sífilis (comúnmente anticuerpos treponema pallidum IgG) 2,3 y la prueba QuantiFERON son recomendadas para todos los pacientes de uveítis, así como una radiografía de tórax. Las pruebas adicionales se adaptan de acuerdo a la presentación clínica de la persona. Algunos especialistas aseguran que las pruebas de rutina para la tuberculosis no son indicadas si las conclusiones del examen no lo sugieren (por ejemplo, las lesiones serpiginosas, el granuloma coroideo o la vasculitis oclusiva). No obstante, la prueba de QuantiFERON vale todavía la pena como una condición previa para cualquier terapia inmunomoduladora sistémica prevista.
Si, después de una prueba de diagnóstico apropiada, la preocupación persiste debido a una infección críptica (tal como la endoftalmitis fúngica endógena o la toxoplasmosis atípica), habría que considerar la posibilidad de un período de tres a seis semanas de ensayo de corticosteroides orales antes que cualquier corticosteroide local (periocular o intravítreo) inyectado. Hay que seguir al paciente muy de cerca durante las dos primeras semanas de terapia. Un empeoramiento de los síntomas después de que el paciente comience con los esteroides orales es una señal para reexaminar la posibilidad de una uveítis infecciosa.
Si el paciente pasa la «prueba de esteroides oral», el siguiente paso es una inyección de esteroides local. Una vez más, cualquier empeoramiento de la inflamación inmediatamente después de una inyección de esteroides local, debería indicar la posibilidad de una infección oculta. Las uveítis no infecciosas deberían típicamente responder a esteroides locales durante al menos varias semanas. La enfermedad puede recrudecer meses más tarde. En este punto, recomiendo discutir acerca de terapia inmunomoduladora sistémica.
¿Por qué terapia sistémica?
Los especialistas de la retina tienen muchas buenas opciones de terapia local, incluyendo la triamcinolona periocular, triamcinolona intravítrea, el implante intravítreo de dexametasona (Ozurdex, Allergan), y el implante intravítreo de fluocinolona acetonide 0,59 mg (Retisert, Bausch+Lomb).
Además, el sirolimus intravítreo (Santen) es el objeto de los ensayos de Fase III y tiene una designación de medicamento huérfano en Estados Unidos y Europa, y estudios de investigación están examinando un aplicador de fluocinolona acetonide intravítrea inyectable de 0,18 mg (pSivida). ¿Por qué asumir el «dolor de cabeza» de la terapia sistémica economizadora de esteroides?
Muchos pacientes padecen de enfermedad bilateral, y mantener esos ojos fuera de la sala de operaciones, es un loable objetivo. La terapia con esteroides locales repetida en el transcurso de los años a menudo provoca catarata y glaucoma.
Subsecuentemente, la cirugía de catarata y glaucoma puede, en realidad, empeorar la inflamación y provocar secuelas anatómicas (sinequia, depósitos de fibrina en una lente intraocular, fibrosis vítrea anterior y opacidad o edema macular) que posteriormente degrade más la visión; una espiral de muerte virtual por complicaciones uveíticas y frustración.
Lecciones del Estudio MUST
Los datos procedentes del Estudio Multicéntrico de Tratamiento de la Uveítis por Esteroides (MUST) merecen la atención. Dos ramas del estudio compararon el implante de fluocinolona acetonide a la terapia inmunomoduladora sistémica. A los 4,5 años, los resultados en agudeza visual, fueron similares entre las dos ramas.6, 7 Las complicaciones sistémicas fueron mínimas y equivalentes entre las dos ramas, pero la rama del implante mostró complicaciones locales, incluyendo cataratas, hipertensión ocular y la necesidad de cirugía para el glaucoma.
Especialmente para la enfermedad bilateral, la terapia sistémica debe ser una mejor elección inicial, dada su eficacia y seguridad ocular y sistémica. Recientemente, el reporte de siete años de seguimiento extendido mostró un promedio de ventaja de 7,2 letras en agudeza visual, para la terapia sistémica vs. el implante de fluocinolona.8
Clave: GI = gatrointestinal; BM Supp = Supresión de médula ósea; HTN = hipertensión
Desde una perspectiva de estilo de vida, los pacientes suelen preferir un régimen de unas cuantas píldoras diarias y/o una inyección subcutánea bisemanal junto con pruebas de laboratorio cada dos a tres meses, en lugar de gotas diarias, periódicas inyecciones peri o intraoculares y probablemente múltiples cirugías intraoculares (con las consiguientes complicaciones) durante un período de tratamiento que puede extenderse de 5 a 10 años.
| Medicación | Control a los seis meses | Control a los 6 meses con Prednisolona ≤10 mg | Control a los 12 meses | Control a los 12 meses con Prednisolona ≤10mg | Descontinuación secundaria a los efectos sistémicos colaterales al año (evento/persona-año) | Descontinuación secundaria a los efectos sistémicos colaterales al año(Kaplan-Meier) | Comentarios |
| Metotrexato | 63% | 37% | 74% | 58% | General 0.13, GI 0.02, Supresión de MO 0.02, Enzimas hepáticas 0.02 | General 17.5%, GI 3.3%, Sup. MO 3%, Enzimas hepáticas 3.6% | Menos efectivo para uveítis posterior |
| Azatioprina | 57% | 32% | 73% | 47% | General 0.16, GI 0.06, Sup MO 0.03, Enzimas hepáticas 0.03 | General 24.1%, GI 10.8%, Sup MO 3.5%, Enzimas hepáticas 4.9% | 9% necesita terapia de combinación; buen medicamento intermedio para uveítis |
| Micofenolato | 77% | 41% | 91% | 55% | General 0.10, GI 0.02, Sup MO 0.01, Enzimas hepáticas 0.01 | General 14.5%, GI 3.1%, Sup MO 2.1%, Enzimas hepáticas 1.5% | |
| Ciclosporina | 61% | 22% | 76% | 36% | General 0.07, HTN 0.02, Renal 0.02, BM sup 0.001, Enzima hepática 0.006 | General 10.7%, HTN 3.2%, Renal 2.5%, BM sup 0%, Enzima hepática 11.1% | 17% necesita terapia de combinación, más toxicidad a la edad >55 |
Los riesgos de la Terapia Sistémica
Lamentablemente, la percepción de que los medicamentos sistémicos son «venenos» que relegan a un paciente al futuro riesgo de cáncer u otras complicaciones, puede detener a algunos oftalmólogos o pacientes. Afortunadamente, existen buenos datos. La Terapia Inmunosupresora Sistémica
para Enfermedades Oculares (SITE) no mostró un aumento general de la mortalidad relacionada con el cáncer o la uveítis, en pacientes tratados con terapia inmunomoduladora sistémica.9
Sin embargo, puede existir un pequeño aumento del riesgo de cáncer de piel, así que hay que aconsejar a los pacientes que usen protector solar y ropa protectora, y que presten atención a cualquier nueva lesión cutánea, y que se sometan a un periódico examen de la piel.10
Cuándo usar la Terapia Sistémica
Un patrón de recurrencia de la enfermedad, frecuente e importante y que trastorna la vida de un paciente, es a menudo una indicación para el uso de la terapia sistémica. Indicadores clásicos son las secuelas anatómicas tales como la sinequia progresiva y el iris abombado o el cierre del ángulo, presión intraocular (PIO) de respuesta a esteroide, atrofia óptica glaucomatosa, cataratas, opacidad vítrea, edema macular uveítico, deserción del lecho capilar retinal y fibrosis macular asociada a neovascularización inflamatoria coroidea.
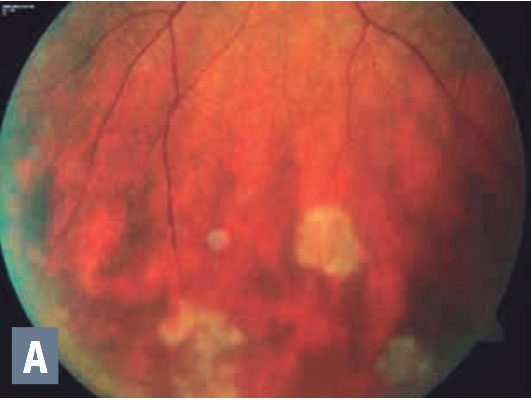
Otras indicaciones para la terapia sistémica incluyen pérdida del epitelio pigmentario de la retina, asociada con degeneración retiniana periférica o retinopatía en perdigonada (Figura 1, página 23), retinopatía aguda zonal oculta externa, enfermedad de Vogt-Koyanagi-Harada [VKH] y de indicadores funcionales tales como la pérdida del campo visual (Figura 2).
Enfermedades con conocido pronóstico desfavorable (enfermedad de Behcet, retinopatía en perdigonada y VKH) que inevitablemente humean y provocan recaídas, pueden ser tratadas prontamente con terapia sistémica economizadora de esteroides, incluso en ausencia de un historial de recurrencia o de secuelas importantes.11 Entre antes comienzan estos pacientes graves la terapia sistémica, mejor resulta a largo plazo.
Un enfoque simplificado
Los siguientes agentes sistémicos están indicados para la uveítis infecciosa:
• Antimetabolitos. El estudio SITE examinó el uso de azatioprina, 12 y metotrexato13 y micofenolato (Tabla 2).14 Una lección del estudio SITE es que aumentan las tasas de control de 6 a 12 meses, por lo que se debe hacer énfasis en la paciencia y en las perspectivas a largo plazo en las discusiones con el paciente.
Los principales efectos secundarios de los antimetabolitos son: malestar gastrointestinal, supresión de la médula ósea y anormalidades hepáticas. El malestar digestivo suele mejorar después de una a dos semanas de terapia, pero algunos pacientes van a tener que interrumpir un agente después de un par de semanas y buscar una alternativa.
El malestar digestivo es idiosincrático dentro de la familia de antimetabolitos. Algunos pacientes pueden desarrollar síntomas con un agente y con otro, no. Verifíquese el conteo sanguíneo completo (CSC) y el perfil metabólico (CMP), con atención en las enzimas hepáticas en el punto de partida y después de dos a tres semanas de la terapia inicial. A partir de allí, compruebe los laboratorios cada dos o tres meses y de tres a cuatro semanas después de cualquier aumento de la dosis.
El micofenolato viene en tabletas de 250 mg y 500 mg. La dosificación típica empieza con 500 mg dos veces al día y aumenta hasta 1.000 mg en cuatro a seis semanas. La dosificación máxima es de 1.500 mg dos veces al día. El micofenolato es popular entre los antimetabolitos, porque puede tener una incidencia levemente menor en los efectos secundarios y, por lo tanto, es a menudo la primera opción para comenzar la terapia.
El metotrexato viene en tabletas de 250 mg y 500 mg. El metotrexato también puede administrarse como inyección subcutánea. Independientemente, el metotrexato se dosifica semanalmente, generalmente se comienza con de 7,5 a 15 mg por semana y luego se aumenta, según sea necesario. La dosis máxima es de 25 mg por semana. Los pacientes deben tomar 1 mg de folato durante los otros seis días de la semana y dramáticamente reducir o evitar el consumo de alcohol. El metotrexato es menos efectivo para la uveítis posterior o la panuveítis.
La azatioprina está disponible en tabletas de 50 mg. La dosificación se basa en el
peso corporal; 1-3 mg/kg/día, lo cual se traduce generalmente en comenzar con 50 mg al día y aumentar a 100 mg o 150 mg, al día, durante los primeros uno a tres meses. Evitar este medicamento en pacientes bajo allopurinol para gota, porque puede aumentar los efectos secundarios sobre la médula ósea. La azatioprina es un buen medicamento intermedio para la uveítis y una medicina decente para la uveítis posterior /panuveítis (Figura 3).
• Inhibidores de Anticuerpos-T. La Ciclosporina (Gengraf, Neoral, Sandimmune AbbVie; y Novartis) es un inhibidor de células T con un perfil de efectos secundarios ligeramente diferente a los antimetabolitos. Sugiero evitar Sandimmune, una formulación más antigua. Viene en tabletas de 100 mg o 25 mg. La dosificación comienza alrededor de 2 mg o 3 mg/kg diarios y puede ir hasta 5 mg/kg, terminando típicamente en alrededor de un total de 150-300 mg diarios. Una buena dosis de inicio para la mayoría de los pacientes suele ser de 100 mg dos veces al día.15 Para el tratamiento de la uveítis, a diferencia de los trasplantes de órganos, el control de los niveles en la sangre no es necesario.
Colaborando con el Reumatólogo: Lo que se debe y lo que no se debe hacer
Con respecto a pacientes saludables en sus veintes, treintas y cuarentas, usted puede ciertamente verificar el hemograma (CBC), un análisis bioquímico (CMP) y la presión sanguínea de cada dos a tres meses. Esto no impide la colaboración con un reumatólogo para los pacientes más jóvenes, pacientes más viejos o pacientes con problemas de salud adicionales.
Algunas cosas que se pueden hacer y que no se pueden hacer en las relaciones con el reumatólogo y que merecen mención.
- No remita un nuevo paciente de uveítis al reumatólogo diciendo «Trabaja con este paciente». El oftalmólogo tiene la ventaja del examen ocular, lo cual permite el desarrollo de un diagnóstico diferencial propio. Los reumatólogos comprensiblemente se sienten frustrados cuando se les remite un paciente de «uveítis “genérico y se les deja en la posición de ordenar un amplio examen no selectivo, de bajo rendimiento.
- Ordene un examen de diagnóstico enfocado, antes de enviar al paciente con el reumatólogo.
- No copie la nota generada para el reumatólogo en un expediente médico electrónico (EMR) y espere que la descifre «1+ célula, 2+ célula,»etc. y posteriormente decida si la dosis debe aumentar o disminuir.
- Envíe una carta o nota de expediente médico electrónico, personalizada, en cada visita. Resuma los hallazgos inflamatorios del examen ocular del paciente en términos claros: «Al paciente le va bien y el régimen debe dejarse como está»; o «El paciente muestra cierto avance inflamatorio; voy a emprender alguna terapia local limitada a corto plazo, pero ¿podría usted considerar el incremento en la dosis [nombre del agente ahorrador de esteroide] del paciente? o ¿añadir [nombre del segundo agente ahorrador de esteroide]? o «El paciente ha estado tranquilo durante dos años, ¿podría usted considerar una reducción incremental de la dosis de [nombre del agente ahorrador de esteroide] como parte de un programa a largo plazo?
- Sugiera agentes específicos y rangos en la dosis. Siempre establezca cuando va a tener lugar la próxima evaluación oftalmológica del paciente.
Nuestros indicadores- examen de oftalmología, angiograma, Tomografía de Coherencia Óptica y campo visual-tienen mayor poder que un análisis de sangre que el reumatólogo pueda ordenar para controlar la respuesta de la enfermedad. Somos responsables de la toma de decisiones para con estos pacientes.
Las principales preocupaciones con la ciclosporina son la toxicidad renal, hipertensión, anormalidades hepáticas, baja de magnesio, niveles elevados de lípidos y parestesias. El perfil de efectos secundarios de la ciclosporina es mejor de lo que la mayoría de los médicos reconoce. El medicamento tiende a ser bien tolerada en pacientes menores de 55 años de edad y puede ser utilizada en las poblaciones de mayor edad bajo una estrecha vigilancia.
Los pacientes deben evitar el uso intenso de antiinflamatorios no esteroideos (AINES) porque puede aumentar la toxicidad renal. Recomendar frecuentes controles de presión arterial y pedir a los pacientes que mantengan un registro. Controlar el hemograma, la química sanguínea con atención a la concentración sérica de creatinina y el aclaramiento de creatinina calculado y de magnesio, cada mes o dos meses, inicialmente y cada dos o tres meses después.16 Los pacientes también deben hacerse perfiles lipídicos una o dos veces al año.
Tacrolimus (Prograf, Astellas) es un inhibidor de células T con un perfil de efectos secundarios y régimen de vigilancia similar a la ciclosporina. Mientras la ciclosporina tiene una historia más larga en el tratamiento de la uveítis, tacrolimus puede tener una incidencia levemente inferior en los problemas de riñón y de presión arterial.17 Conservadoramente, la dosificación oscila entre 0,05 mg y 0,10 mg/kg diariamente. Viene en tabletas de 1 mg de tamaño. Los pacientes a menudo, comienzan con 1 mg dos veces al día y pueden llegar hasta 3 mg dos veces al día.
• Biológica. Infliximab (Remicade, Janssen), suministrada como una infusión intravenosa cada cuatro a seis semanas, había sido el prototipo de agente anti-factor de necrosis tumoral (TNF) utilizado para la uveítis.18,19 Adalimumab (Humira, AbbVie), un agente anti-TNF que el paciente típicamente se auto administra quincenalmente como inyección subcutánea, se ha convertido en una opción popular y eficaz para la uveítis, especialmente desde que la FDA concedió una etiqueta de indicación para uveítis no infecciosas.20,21 Adalimumab es el único agente no corticosteroide sistémico, aprobado por la FDA para el tratamiento de la
Los agentes anti-TNF
Se consideran como terapia de primera línea para la enfermedad de Behcet y como agentes de segunda línea para otras presentaciones de uveítis.20 En términos prácticos, estos agentes se usan a menudo en combinación con un antimetabolito, cuando la monoterapia con antimetabolito muestra alguna respuesta, pero es necesaria una mayor efectividad.
Adalimumab se suministra con una dosis inicial de 80 mg, seguida de 40 mg una semana más tarde y, posteriormente, 40 mg cada dos semanas. Los pacientes deben tener prueba QuantiFERON negativa antes de iniciar el tratamiento, debido a que el agente puede reactivar las infecciones tuberculosas latentes. El sub-especialista de la retina haría bien en consultar con un reumatólogo, para la prescripción y supervisión de infliximab y adalimumab. Estos medicamentos son pilares en reumatología.
Elección inicial de medicamentos
Un elemento de estilo personal es el que conforma la elección inicial de los medicamentos. En los últimos años, el micofenolato se ha vuelto cada vez más popular como primer fármaco en todos los grupos de edad adulta. Para la uveítis intermedia, micofenolato o azatioprina son buenas opciones de primera línea. En pacientes jóvenes con significativa uveítis posterior o panuveítis, ciclosporina sola o en combinación con micofenolato o azatioprina es una buena primera opción. En pacientes de edad avanzada, se puede iniciar con el antimetabolito solo. En los niños, el metotrexato es a menudo el primer fármaco de elección.
Consejos a los pacientes
Aconsejar a los pacientes a ser cuidadosos acerca de la exposición al sol y sobre la importancia del uso de protector solar. También deberían evitar las vacunas vivas. Aunque es raro, cualquier paciente de inmunosupresión, corre el riesgo de leucoencefalopatía multifocal progresiva, asociada a virus, de John Cunningham. Consultar con un neurólogo si se desarrolla alguna nueva aparición de los síntomas neurológicos.
Problemas relacionados con el embarazo
Las mujeres en edad de embarazo con uveítis que requieren terapia inmunomoduladora deberían recibir asesoramiento sobre la necesidad de una anticoncepción adecuada. Generalmente un método hormonal (por ejemplo, comprimidos orales o una inyección de depósito) es insuficiente, y a los pacientes generalmente se les recomienda usar un segundo método concomitante, usualmente, un método de barrera.
Para los especialistas de la retina, comunicarse con el obstetra, ginecólogo o médico de familia de la paciente sobre la necesidad de una anticoncepción adecuada asociada con terapia inmunomoduladora normalmente es suficiente. Verifique con el paciente en visitas posteriores, que sea compatible con las recomendaciones del ginecólogo.
Cuando las mujeres con uveítis desean quedar embarazadas, la terapia sistémica debe disminuirse hasta el final al menos tres meses antes de intentar la concepción. A pesar de algunos debates sobre si agentes como la ciclosporina pueden ser utilizados durante el embarazo, por lo general, estos pacientes deben evitar la supresión inmunitaria porque el propio embarazo puede tener algunos efectos supresores del sistema inmune. Los esteroides tópicos, inyectados u orales, pueden a menudo manejar exacerbaciones durante el embarazo.
Tabla 3. Programa para ajustar la dosis
| Agente | Aumento/Disminución de dosis |
| Micofenolato | 500 a 1000 mg al día |
| Azatioprina | 50 mg/día |
| Metotrexato | 2.5 a 7.5 mg/semanal |
| Ciclosporina | 50 a 100 mg diario |
Niños con uveítis
Un importante conjunto de literatura apoya el uso de terapia inmunomoduladora sistémica en niños con uveítis.22, 23 Los niños presentan problemas médicos especiales y consideraciones de dosificación, de manera que la colaboración es importante, ya sea con un reumatólogo pediatra, un pediatra familiarizado con la terapia sistémica o un reumatólogo para adultos, cómodo en el manejo de los niños.
Los niños suelen tolerar la terapia sistémica muy bien, por lo que el tratamiento debe ser iniciado pronto en el curso de la enfermedad. Por el contrario, las inyecciones de esteroides en los niños a menudo estimulan rápidamente las cataratas relacionadas con esteroides y la hipertensión ocular, incitando a la cirugía que puede provocar una inflamación adicional y complicaciones anatómicas, causando un descenso en espiral clínico. Las inyecciones de esteroides locales tienen un papel en el tratamiento de la uveítis en los niños, pero deben utilizarse con cautela y moderación.
En el marco del edema macular, un período de tres a seis semanas de esteroides orales (con dosis de 0,5 mg a 1 mg/kg diarios) va a poder tratar el edema macular a corto plazo y evitar la necesidad de una inyección de esteroides. Los esteroides orales a corto plazo, generalmente conllevan un menor riesgo de catarata y glaucoma que una inyección. El uso de los esteroides orales en esta forma, permite que el tiempo actúe, para que la terapia sistémica empiece a surtir efecto.
En los niños con pars planitis, la membrana de pars plana va a involucionar lentamente a lo largo de uno a tres años. Busque el menos localizado haze que recubre la membrana, una coloración más gris y menos blanca de la membrana, y que va disminuyendo el grosor de la membrana. Las células vítreas suelen persistir en el nivel de 1 a 2+ en estos pacientes, lo cual plantea la pregunta de si el medicamento está surtiendo el efecto deseado.
Tabla 4. Guía del panel de expertos para disminuir la prednisolona
| Dosis Diaria | Programa de disminución |
| > 40 mg | Disminuir 10 mg/semana de cada 1 a 2 semanas |
| 40 a 20 mg | Disminuir 5 mg/semana de cada 1 a 2 semanas |
| 20 a 10 mg | Disminuir 2.5 mg cada 1 a 2 semanas |
| 10 a 0 mg | Disminuir 1 mg cada 1 a 4 semanas |
na vez más, el paciente es la clave. Si la cámara anterior está despejada, el vítreo central está libre de haze significativo, y ningún edema macular es evidente, el paciente probablemente está moviéndose en la dirección correcta, incluso con ciertas células vítreas y una membrana celular que cambia sólo lentamente. Cuando la membrana se estabilice y se contraiga a lo largo de uno a tres años, el paciente puede desarrollar algo de retinosquisis traccional, lo cual se puede observar mejor, a menos que amenace la visión.24
Eficacia y ajuste de dosis
Nada es perfecto; y hay que esperar avances inflamatorios durante la terapia sistémica, la mayoría de los cuales tienden a ser bastante leves y tratables con esteroides tópicos, inyectados u orales. El vítreo no necesita estar libre de células. En mi experiencia (otros sub-especialistas pueden discrepar), los pacientes pueden tener de 1 a 2+ de células vítreas y permanecer «controlados» y estables a largo plazo: la cámara anterior tiene ½+ o menos células; las células del humor vítreo, mientras lleguen hasta 2+, están relativamente fijas en el gel y pigmentadas; y el ojo carece de haze vítreo, importantes fugas retinovasculares en la angiografía fluoresceínica (AFG) o edema anatómico en OCT. La visión es generalmente buena y el paciente nota ocasionalmente la miodesopsia, pero en general hay buena función visual subjetiva.
Utilizar todos los parámetros disponibles, tal como se ha indicado para el examen de la enfermedad en particular, OCT, angiograma con barrido o angiografía por fluoresceína de campo amplio. Para enfermedades como la retinopatía en perdigonada, la coroiditis serpiginosa, VKH y la retinopatía aguda zonal oculta externa (AZOOR), considere un campo visual cada 12 meses para evaluar la respuesta a la terapia. Los campos de Goldmann son ideales, pero difíciles de obtener; normalmente un 30-2 Sita-Standard automatizado o una prueba similar será suficiente. Si un paciente se está retrasando en una conclusión, por ejemplo, el edema macular uveítico persistente o recurrente en Tomografía de Coherencia Óptica (OCT), fugas recurrentes y expansión de neovascularización coroidea inflamatoria refractaria a la terapia anti-VEGF, considere aumentar la dosis (Tabla 3).
Documente la fecha y la magnitud de todos los cambios de dosis cuidadosamente en el gráfico. El estudio SITE claramente demuestra que la terapia inmunomoduladora tarda de seis a 12 meses para que realmente surta pleno efecto.9 Al aumentar la dosis, busque una señal biológica de alguna eficacia en aproximadamente tres meses, pero recuerde que el efecto total de un aumento de la dosis puede tardar seis meses (hasta 12), para manifestarse. Sea paciente y utilice esteroides orales e inyecciones de esteroides locales juiciosamente, para reducir el tiempo necesario para que un cambio de dosis surta efecto. Considerar la terapia combinada, según corresponda.
Seguridad y ajuste de dosis
La mayoría de los pacientes en terapia sistémica deben hacerse una prueba CBC y CMP cada dos a cuatro meses. Con respecto a los antimetabolitos, si un laboratorio devuelve un recuento levemente deprimido de hemoglobina o de glóbulos blancos o levemente elevado de transaminasas hepáticas, que no cunda el pánico. En primer lugar, repetir el laboratorio para verificar el valor anormal. Si el paciente, por otra parte, está evolucionando bien, la terapia puede continuar. De lo contrario, reducir la dosis con un incremento significativo (Cuadro 3, página 27) y, posteriormente, repetir los laboratorios tres o cuatro semanas después. Si el paciente tiene otras complicaciones no oculares o los laboratorios anormales persisten, consulte con un médico internista o reumatólogo.
Los pacientes propensos a alta presión sanguínea (edad avanzada, antecedentes familiares, sobrepeso, altos niveles de estrés o apnea del sueño no tratada) pueden desarrollar algunas elevaciones de la presión sanguínea en la ciclosporina o tacrolimus, pero una elevación ligera no excluye el uso de estos medicamentos. Consultar al médico internista del paciente. Los factores subyacentes que predisponen a un paciente a la presión sanguínea alta pueden ser abordados y a menudo puede ser prescrita una medicación antihipertensiva. Del mismo modo, si un paciente de ciclosporina o tacrolimus muestra un pequeño salto en la creatinina sérica, considere la posibilidad de una reducción de dosis incremental con reevaluación de los valores de laboratorio, de uno a dos meses más tarde.
La terapia inmunomoduladora también puede continuar en el marco de infecciones sistémicas menores. Como medida de precaución, aconsejar a los pacientes que tienen un umbral bajo, que vean a su médico de atención primaria cuando se sientan enfermos, especialmente cuando los síntomas persistan. Los médicos de atención primaria que saben que un paciente está en inmunosupresión pueden ser más propensos a recetar antibióticos de bajo grado, para enfermedades adquiridas en la comunidad. El ensayo MUST, informó de una baja tasa de infecciones que requieren tratamiento, tanto en los grupos de implantes como en los de terapia sistémica.7 Los investigadores sugirieron que estas infecciones «no estaban asociadas con ninguna consecuencia duradera» y, por lo tanto, eran en general leves.6,7
El efecto ahorrador de esteroides
Muchos pacientes de uveítis están bajo prednisolona o necesitan prednisolona inicialmente, así que algunas sugerencias para el uso de prednisolona figuran en el orden. No utilice el Medrol Dosepak (metilprednisolona, Pfizer); la duración es demasiado corta. Prescribir la prednisolona oral, generalmente de 50 a 60 mg al día en adultos (aproximadamente 1 mg/kg/día). Idealmente, el paciente debería comenzar una disminución a las cuatro semanas, con una meta de 10 mg diarios o menos en tres meses. Un grupo de expertos elaboró directrices para disminuir la prednisolona (Tabla 4).15 Lógicamente, el incremento en la rebaja disminuye con el tiempo.
La prednisolona oral crónica requiere de una estrecha atención a los azúcares, a la presión arterial y a los problemas de densidad ósea. Se recomiendan suplementos de calcio de 1.000 a 1.500 mg al día y de vitamina D3 de 800 a 1.000 UI diarias.
• Pasando de 10 mg a cero. La mayoría de los pacientes en la terapia sistémica adecuada van a disminuir hasta la dosis baja de los adolescentes con respecto a la prednisolona oral, pero a menudo, estos últimos 10 mg de prednisolona pueden presentar un desafío. En pacientes difíciles de desenganchar, adoptar una lenta «larga cola» para esa última rebaja de 10 mg. Disminuir en 1 mg de cada uno a dos meses. Gastar un año para llegar a cero, es aceptable en pacientes difíciles. Establecer una tasa de exacerbaciones.
Un ejemplo: si un paciente con micofenolato y ciclosporina, toma 3 mg de prednisolona oral diaria y luego tiene un leve avance, volver atrás con la prednisolona hasta 10 mg, suplementada según sea necesario con esteroides locales, lograr la quiescencia de nuevo y, a continuación, reanudar la rebaja, unas semanas o meses más tarde. Si los agentes sistémicos se quedan en la misma dosis, bajar a 4 o 5 mg al día (justo por encima de la dosis de exacerbación) y, a continuación, dejar al paciente en ese nivel indefinidamente, con el conocimiento de que una dosis así de baja de prednisolona oral crónica es bastante bien tolerada. No todos los pacientes llegarán a cero, pero eso es aceptable.
Alternativamente, en el momento de avance, aumentar la dosis del agente economizador de esteroides. Suministrar esta dosis aumentada durante tres a seis meses para que surta efecto antes de intentar volver a sumergirse por debajo de la «dosis de exacerbación» y llegar a cero.
Papel de la terapia de combinación
Así como el estudio de SITE demostró (Tabla 2), que la monoterapia funciona bastante bien, pero que del 20 al 40% de los pacientes puede necesitar terapia de combinación, ya sea: por progresión o recurrencia en monoterapia, un deseo de efecto de rebaja de esteroides o por severidad de la enfermedad. La terapia combinada es bien tolerada. La toxicidad es relativamente baja, especialmente en los jóvenes, que tienen más interés en juego.
La combinación tradicional es un antimetabolito (metotrexato, micofenolato o azatioprina) más un inhibidor de células T (ciclosporina o tacrolimus). Una combinación cada vez más popular es un antimetabolito combinado con un agente anti-TNF, usualmente, el adalimumab. Los reumatólogos se sienten bastante cómodos con esta combinación y pueden colaborar con usted.
La monoterapia a menudo no puede detener enfermedades difíciles, como la deserción vascular en la enfermedad de Behcet o las cicatrices coriorretinianas de VKH, la oftalmía simpática o la coroiditis serpiginosa. La terapia de combinación inicial está indicada en estos casos. Si el paciente responde muy bien en el primer año de terapia de combinación, un agente puede ser cuidadosamente rebajado.
Disminución
Si el régimen inmunomodulador ha alcanzado la quiescencia de la enfermedad de dos años o más, se puede considerar una disminución. El primer paso es verificar que el paciente quiere disminuir la terapia. No es sorprendente que los pacientes disfruten de la estabilidad de la quiescencia de la enfermedad y pueden optar por seguir un régimen más que correr el riesgo de una crisis.
La regla principal es proceder lentamente. Normalmente, en este momento, usted ha seguido al paciente durante varios años y conoce el patrón de enfermedad del individuo.
En el caso de terapia de combinación, disminuya primero el agente más débil en un régimen de multi-agente, pero cualquier problema de toxicidad tiene precedencia. Disminuya en pequeños incrementos a lo largo de seis a 18 meses. Si no puede lograr una disminución completa, no se vea esto como un fracaso; lograr una menor dosis general a largo plazo es en sí misma un éxito. No tiene nada de vergonzoso, la reanudación de un régimen previamente exitoso si eso es lo que se necesita para preservar la visión a largo plazo.
Qué decirle a los pacientes
Los pacientes con frecuencia, luchan con un diagnóstico de «uveítis». Después de todo, seguramente ninguno de sus conocidos padece de uveítis, y una falta de etiología tras extensos exámenes médicos puede ser frustrante. Mientras el médico debe decirle al paciente que el diagnóstico es uveítis, es útil a menudo agregar que, «La uveítis es la artritis reumatoide del ojo, y utilizamos los mismos medicamentos que los reumatólogos usan en cientos de miles de personas para tratar la artritis».
También puede decir que «El sistema inmunológico puede ser hiperactivo o autoinmune en cualquier parte del cuerpo, por razones que no entendemos completamente, y que la enfermedad ocular autoinmune se llama uveítis.» Estas explicaciones permiten a los pacientes de uveítis relacionarse con el mayor y mejor conocido grupo de pacientes con enfermedades autoinmunes y articulares y a menudo aliviar la ansiedad.
Y, por último, para los médicos, no permita que una falta de etiología retrase la terapia. No dude en iniciar la terapia sistémica en lugar de repetidas inyecciones de esteroides. Considérese la analogía de un trasplante. A todos nos ha preguntado algún paciente ciego, “¿Doctor, hay un trasplante de ojo disponible?» Si un oftalmólogo desarrollara una técnica de trasplante de ojo, este cirujano se ganaría todos los premios en nuestro campo y sería aclamado como un héroe. Nadie pondría en tela de juicio la utilización de fármacos inmunosupresores para «pacientes con trasplante de ojo», pero el uso de estos fármacos Inmunosupresores para preservar la visión en los pacientes con uveítis tiene una trayectoria de 35 años.
REFERENCIAS
- Thorne JE, Suhler E, Skup M, et al. Prevalence of noninfectious uveitis in the United States: A claims-based analysis. JAMA Ophthalmol. 2016;134:1237-1245.
2. Interpretive Handbook Test 34510: Syphilis IgG antibody with reflex, serum clinical information. Mayo Clinical Mayo Medical Laboratories. http://www.mayomedicallaboratories.com/interpretive-guide/?alpha=S&unit_code=34510 Accessed May 9, 2017.
3. Test Center: Syphilis antibody cascading reflex. Quest Diagnostics. http://www.questdiagnostics.com/testcenter/BUOrderInfo.action?tc=90349&labCode=DLO Accessed May 9, 2017
4. Nguyen QD, Merrill PT, Clark WL, et al. For the Sirolimus study Assessing double-masKed Uveitis tReAtment (SAKURA) Study Group. Intravitreal sirolimus for noninfectious uveitis: A Phase III Sirolimus Study Assessing Double-masKed Uveitis TReAtment (SAKURA). Ophthalmology. 2016;123:2413-2423.
5. Jaffe GJ, Lin P, Keenan RT, Ashton P, Skalak C, Stinnett SS. Injectable fluocinolone acetonide long-acting implant for noninfectious intermediate uveitis, posterior uveitis and panuveitis: Two-year results. Ophthalmology. 2016;123:1940-1948.
6. Multicenter Uveitis Steroid Treatment (MUST) Trial Research Group. Kempen JH, Altaweel MM, Drye LT, et al. Benefits of systemic anti-inflammatory therapy versus fluocinolone acetonide intraocular implant for intermediate uveitis, posterior uveitis, and panuveitis: Fifty-four-month results of the Multicenter Uveitis Steroid Treatment (MUST) Trial and Follow-up Study. Ophthalmology. 2015;122:1967-1975.
7. Multicenter Uveitis Steroid Treatment (MUST) Trial Follow-up Study Research Group. Quality of life and risks associated with systemic anti-inflammatory therapy versus fluocinolone acetonide intraocular implant for intermediate uveitis, posterior uveitis, or panuveitis: Fifty-four-month results of the Multicenter Uveitis Steroid Treatment Trial and Follow-up Study. Ophthalmology. 2015;122:1976-1986.
8. Writing committee for the Multicenter Uveitis Steroid Treatment (MUST) Trial and Follow-up Study Research Group. Association between long-lasting intravitreous fluocinolone acetonide implant vs systemic anti-inflammatory therapy and visual acuity at 7 years among patients with intermediate, posterio, or panuveitis. JAMA. 2017;317:1993-2005.
9. Kempen, J.H., Daniel, E., Dunn, J.P. et al, Overall and cancer related mortality among patients with ocular inflammation treated with immunosuppressive drugs: retrospective cohort study. BMJ.2009;339:b2480
10. Yates WB, Vajdic CM, Na R, McCluskey PJ, Wakefield D. Malignancy risk in patients with inflammatory eye disease treated with systemic immunosuppressive therapy. Ophthalmology. 2015;122:265-273.
11. Bykhovskaya I, Thorne JE, Kempen JH, Dunn JP, Jabs DA. Vogt-Koyanagi-Harada disease: clinical outcomes. Am J Ophthalmol. 2005 ;140:674-678
12. Pasadhika S, Kempen JH, Newcomb CW, et al. Azathioprine for ocular inflammatory diseases. Am J Ophthalmol 2009;148:500-509.e2.
13. Gangaputra S, Newcomb CW, Liesegang TL, et al. For the Systemic Immunosuppressive Therapy for Eye Diseases Cohort Study. Methotrexate for ocular inflammatory diseases. Ophthalmology. 2009;116:2188-9218.e1.
14. Daniel E, Thorne JE, Newcomb CW, et al. Mycophenolate mofetil for ocular inflammation. Am J Ophthalmol. 2010; 149:423-432.
15. Kaçmaz RO, Kempen JH, Newcomb C, et al. Cyclosporine for ocular inflammatory diseases. Ophthalmology. 2010;117:576-584.
16. Jabs DA, Rosenbaum JT, Foster CS, et al. Guidelines for the use of immunosuppressive drugs in patients with ocular inflammatory disorders: recommendations of an expert panel. Am J Ophthalmol. 2000;130:492-513.
17. Murphy CC, Greiner K, Plskova J, et al. Cyclosporine vs tacrolimus therapy for posterior and intermediate uveitis. Arch Ophthalmol. 2005;123:634-41.
18. Kruh JN, Yang P, Suelves AM, Foster CS. Infliximab for the treatment of refractory noninfectious Uveitis: a study of 88 patients with long-term follow-up. Ophthalmology. 2014;121:358-364.
19. Takeuchi M, Kezuka T, Sugita S, et al. Evaluation of the long-term efficacy and safety of infliximab treatment for uveitis in Behçet’s disease: a multicenter study. Ophthalmology. 2014;121:1877-1884.
20. Levy-Clarke G, Jabs DA, Read RW, Rosenbaum JT, Vitale A, Van Gelder RN. Expert panel recommendations for the use of anti-tumor necrosis factor biologic agents in patients with ocular inflammatory disorders. Ophthalmology. 2014;121:785-796.e3.
21. LaMattina KC, Goldstein DA. Adalimumab for the treatment of uveitis. Expert Rev Clin Immunol. 2017 Mar;13(3):181-188.
22. Gregory AC 2nd, Kempen JH, Daniel E, et al. For the Systemic Immunosuppressive Therapy for Eye Diseases Cohort Study Research Group. Risk factors for loss of visual acuity among patients with uveitis associated with juvenile idiopathic arthritis: the Systemic Immunosuppressive Therapy for Eye Diseases Study. Ophthalmology. 2013;120:186-92.
23. Hersh AO, Cope S, Bohnsack JF, Shakoor A, Vitale AT. Use of immunosuppressive medications for treatment of pediatric intermediate uveitis. Ocul Immunol Inflamm. 2016 Dec 14:1-9.
24. Malalis JF, Bhat P, Shapiro M, Goldstein DA. Retinoschisis in pars planitis. Ocul Immunol Inflamm. 2016;22:1-5.